题目内容
在常温下Ksp[Cu(OH)2]=2×10-20.某CuSO4溶液中,c(Cu2+)=0.02mol/L,在常温下要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调节溶液的pH,使溶液的pH大于( )
| A、2 | B、3 | C、4 | D、5 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:在常温下如果要生成Cu(OH)2沉淀,应满足c(Cu2+)×c2(OH-)≥2×10-20,以此计算溶液的c(OH-),可确定溶液的pH.
解答:
解:已知Ksp=2×10-20,c(Cu2+)=0.02mol?L-1,
在常温下如果要生成Cu(OH)2沉淀,
则c(Cu2+)×c2(OH-)≥2×10-20,
所以c(OH-)≥
=10-9(mol/L),应调节溶液pH大于5,
故选D.
在常温下如果要生成Cu(OH)2沉淀,
则c(Cu2+)×c2(OH-)≥2×10-20,
所以c(OH-)≥
|
故选D.
点评:本题考查难溶电解质的溶解平衡,侧重于浓度的计算,题目难度不大,注意把握计算公式的运用.

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
下列有关说法正确的是( )
| A、因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B、常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 |
| C、在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 |
| D、加热0.1mol?L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强 |
在电解水制取H2和O2时,为增强溶液的导电性,加入一些电解质.下列物质中最合适的是( )
| A、AgNO3 |
| B、H2O |
| C、NaCl |
| D、Na2SO4 |
根据表,以下错误的是( )
| 酸 | 电离常数(25℃) |
| HF | Ki=3.6×10 -4 |
H3PO4 | Ki1=7.5×10 -3 Ki2=6.2×10 -8 Ki3=2.2×10 -13 |
| A、NaF和H3PO4反应的产物只有HF、NaH2PO4 |
| B、0.10 mol/L的溶液,pH由大到小的顺序是Na3PO4>Na2HPO4>NaF>NaH2PO4 |
| C、0.10 mol/L的H3PO4溶液中,0.30 mol/L>c(H+)>0.10 mol/L |
| D、25℃时,等体积、等浓度的NaF和NaH2PO4溶液中所含离子总数前者小于后者 |
化学与生产生活实际密切联系.下列说法不正确的是( )
| A、氢能可再生,没有污染,现已用作火箭和燃料电池的燃料 |
| B、在环保领域,酸性或碱性废水的处理常常利用中和反应 |
| C、为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D、保护轮船船体,多采用外加电流的阴极保护法 |
在强酸溶液中,下列各组离子能够大量共存的是( )
| A、Mg2+、Ca2+、HCO3-、Cl- |
| B、Na+、AlO2-、Cl-、SO42- |
| C、Cu2+、Fe3+、Br-、MnO4- |
| D、K+、Fe3+、SO42-、NO3- |

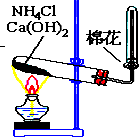 如图所示,是实验室制备某常见气体的实验装置,请填空:
如图所示,是实验室制备某常见气体的实验装置,请填空: