题目内容
下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A、18g NH4+ 所含质子数为10NA |
| B、常温常压下,NA个氢分子的质量为1g |
| C、2mol金属铝与足量的盐酸反应,共失去了4NA个电子 |
| D、在同温同压时,相同体积的任何气体单质所含的分子数相同 |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、根据n=
并结合NH4+的质子个数来分析;
B、根据n=
和m=nM来计算;
C、根据反应后铝的价态来分析;
D、根据阿伏伽德罗定律来分析.
| m |
| M |
B、根据n=
| N |
| NA |
C、根据反应后铝的价态来分析;
D、根据阿伏伽德罗定律来分析.
解答:
解:A、18gNH4+的物质的量n=
=
=1mol,而1molNH4+中含11mol质子,个数为11NA个,故A错误;
B、NA个氢分子的物质的量n=
=1mol,质量m=nM=1mol×2g/mol=2g,故B错误;
C、反应后铝元素变为+3价,故2mol铝反应转移6mol电子,故C错误;
D、根据阿伏伽德罗定律:同温同压下,相同体积的任何气体具有相同的分子数,故D正确.
故选D.
| m |
| M |
| 18g |
| 18g/mol |
B、NA个氢分子的物质的量n=
| N |
| NA |
C、反应后铝元素变为+3价,故2mol铝反应转移6mol电子,故C错误;
D、根据阿伏伽德罗定律:同温同压下,相同体积的任何气体具有相同的分子数,故D正确.
故选D.
点评:本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
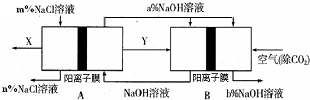 氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( )
氯碱工业是一种高耗能产业,一种将燃料电池与电解池组合的新工艺可节能30%以上,如图是该工艺图示(电极未标出).下列说法正确的是( )| A、X为H2,Y为Cl2 |
| B、A池为电解池,且m<n |
| C、B池为燃料电池,且a>b |
| D、该工艺优点是燃料电池提供电能且能提高烧碱产品的浓度 |
同温同压下,等体积的两容器内分别充满NO和13CO气体,下列对两容器中气体的判断正确的是( )
| A、中子数相同 |
| B、分子数不同 |
| C、质子数相同 |
| D、气体质量相同 |
质量分数为a的某物质的溶液m g与质量分数为b的该物质的溶液n g混合后,蒸发掉p g水,得到的溶液密度为q g/cm3(此过程中无溶质析出),物质的量浓度为c mol?L-1.则溶质的相对分子质量为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
设NA为阿伏加德罗常数,下列说法中正确的是( )
| A、标准状况下11.2L Cl2溶于1L水中,转移电子的数目为0.5NA |
| B、将标准状况下22.4L NO与11.2L O2混合后的体积约为22.4L |
| C、在反应KClO4+8HCl=KCl+4Cl2↑+4H2O中,每生成4mol Cl2转移的电子数为8NA |
| D、O2和O3的混合气体共6.4g,其中所含氧原子数一定为0.4NA |
下列电离方程式中正确的是( )
| A、NaHCO3=Na++HCO3- |
| B、Na2SO4=2Na++SO4-2 |
| C、Ca(NO3)2=Ca2++2(NO3)2- |
| D、KClO3=K++Cl-+3O2- |
0.5molNaOH含Na+ mol,含OH- mol,与 molBa(OH)2所含OH-相同.实验室若配置480mL 0.5mol/LNaOH溶液,需选用容量为 mL的容量瓶,称取NaOH固体 g.