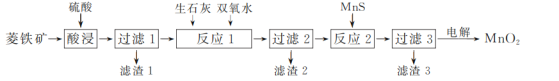
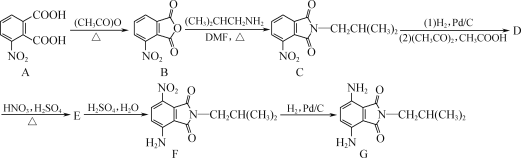
题目内容
【题目】已知还原性I->Fe2+。某溶液X中仅可能含有K+、Na+、Fe2+、Fe3+、NH4+、SO42-、CO32-、I-、Cl-中的一种或多种,且溶液中各离子浓度相同。现进行下列实验,下列说法正确的是 ( )
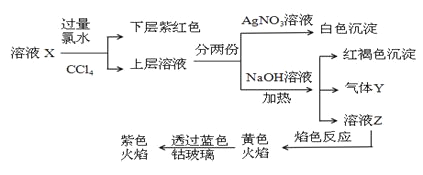
A.该溶液X中可能含有Fe3+
B.该溶液X中可能含有Cl-、Na+
C.该溶液可能是由硫酸亚铁、碘化钾和氯化铵溶于水后得到的
D.取少量溶液Z,向其中滴加BaCl2溶液出现白色沉淀,沉淀可部分溶于稀盐酸
【答案】C
【解析】
由于加入过量的氯水和四氯化碳后,下层呈紫红色,所以原溶液中含有碘离子,上层溶液加氢氧化钠溶液产生红褐色沉淀,说明加入氯水后溶液中存在铁离子,又因铁离子氧化性大于碘单质,因此原溶液中存在亚铁离子而不存在铁离子,根据离子共存可知原溶液不存在碳酸根离子,产生气体说明原溶液中含有铵离子,所得溶液进行焰色反应实验透过蓝色钴玻璃观察到紫色火焰,因此原溶液中含有钾离子,又因溶液中各离子浓度相同,根据电荷守恒分析可知原溶液中存在硫酸根离子和氯离子,故原溶液中一定含有硫酸根、碘离子、亚铁离子和钾离子、铵离子和氯离子。
A.根据上述分析可知原溶液中不存在铁离子,A项错误;
B.根据上述分析可知原溶液中不存在钠离子,B项错误;
C.根据上述分析可知该溶液可能是由硫酸亚铁、碘化钾和氯化铵溶于水后得到的,C项正确;
D.由于原溶液中存在有硫酸根,加入氯化钡后只产生硫酸钡沉淀,不溶于盐酸,D项错误。
故答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】白醋是常见的烹调酸味辅料,白醋总酸度测定方法如下。
i. 量取20.00 mL白醋样品,用100 mL容量瓶配制成待测液。
ii. 将滴定管洗净、润洗,装入溶液,赶出尖嘴处气泡,调整液面至0刻度线。
iii. 取20.00 mL待测液于洁净的锥形瓶中,加3滴酚酞溶液,用0.1000 mol· L-1的NaOH溶液滴定至终点,记录数据。
iv. 重复滴定实验3次并记录数据。
ⅴ.计算醋酸总酸度。
回答下列问题:
(1)实验i中量取20.00 mL白醋所用的仪器是______(填字母)。
|
|
|
|
a | b | c | D |
(2)若实验ii中碱式滴定管未用NaOH标准溶液润洗,会造成测定结果比准确值_____(填“偏大”、“偏小”或“不变”)。
(3)实验iii中判断滴定终点的现象是_______。
(4)实验数据如下表,则该白醋的总酸度为_______mol· L-1。
待测液体积/mL | 标准NaOH溶液 | ||
滴定前读数/mL | 滴定终点读数/mL | ||
第1次 | 20.00 | 0 | 21.98 |
第2次 | 20.00 | 0 | 22.00 |
第3次 | 20.00 | 0 | 22.02 |