题目内容
3.制印刷电路的废液含有大量CuCl2、FeCl2和FeCl3,测得某废腐蚀液中含CuCl21.5mol•L-1、FeCl2 3.0mol•L-1、FeCl3 1.0mol•L-1、HCl 3.0mol•L-1.取废腐蚀液200mL按如下流程在实验室进行实验,
回答下列问题:
(1)用上述方法获得的铜粉中含有杂质,除杂所需试剂是稀盐酸;检验废腐蚀液中含有存在Fe2+的方法是取少量腐蚀液,滴加KMnO4溶液,KMnO4溶液褪色(注明试剂、现象).
(2)实验室可用浓盐酸和固体MnO2反应制备Cl2.此反应中体现了盐酸的酸性和还原性性质,反应的离子方程式为MnO2+4H++2Cl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O.利用图1制备Cl2并通入到FeCl2溶液中获得FeCl3溶液.请从图2中挑选所需的仪器,完成图1中的装置简图(可添加必要的塞子、玻璃导管、胶皮管.不画固定装置),并标明容器中所装试剂名称.

(3)按上述流程操作,需称取Fe粉的质量应不少于39.2g,需通入Cl2的物质的量不少于0.75mol.
分析 腐蚀废液中加入过量的铁粉,三价铁离子与铁反应生成二价铁离子,铜离子与铁反应生成铜和二价铁离子,搅拌过滤得到固体铜和过量的铁粉,滤液为氯化亚铁溶液,向滤渣中加入足量盐酸或稀硫酸溶解铁粉过滤得到纯净的铜,向氯化亚铁溶液中通入氯气反应生成氯化铁,
(1)铜与盐酸不反应,铁粉与盐酸反应生成氯化亚铁;亚铁离子具有还原性,据此解答即可;
(2)依据化学反应方程式判断即可;根据Cl2与FeCl2反应生成FeCl3,考虑尾气吸收画出图即可;
(3)根据铁与CuCl2、FeCl3、HCl反应求出参加反应的铁粉的质量;根据Cl2与FeCl2反应生成FeCl3计算出Cl2的物质的量.
解答 解:(1)铜与盐酸不反应,铁粉与盐酸反应生成氯化亚铁,所以加入盐酸可以除去铜中的铁粉,亚铁离子具有还原性,能与高锰酸钾溶液反应使其褪色,故答案为:稀盐酸;取少量腐蚀液,滴加KMnO4溶液,KMnO4溶液褪色;
(2)二氧化锰与浓盐酸反应生成氯化锰和氯气,其中氯化锰中的氯离子来源于稀盐酸,此时盐酸体现酸性,生成氯气,表现盐酸的还原性,离子反应方程式为:MnO2+4H++2Cl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O,Cl2与FeCl2反应生成FeCl3,用氢氧化钠溶液尾气要吸收,装置为 ;
;
故答案为:2MnO4-+16H++10Cl-═Mn2++5Cl2↑+8H2O;酸性和还原性;  ;
;
(3)Fe+CuCl2 =FeCl2 +Cu
0.3mol 1.5mol•L-1×0.2L 0.3mol
Fe+2FeCl3 =3FeCl2
0.1mol 1.0mol•L-1×0.2L 0.3mol
Fe+2HCl=FeCl2 +H2↑
0.3mol 3.0mol•L-1×0.2L 0.3mol
共消耗Fe粉的物质的量为0.7mol,生成FeCl2的物质的量为 0.9mol,原溶液中含有FeCl2=3.0mol•L-1×0.2L=0.6mol
Fe粉的质量为0.7mol×56g/mol=39.2g,
Cl2+2FeCl2 =2FeCl3
0.75mol 1.5mol
故答案为:39.2;0.75.
点评 本题主要考查了学生铁及化合物的性质,要求学生具有分析和解决问题的能力,难度不大.

| A. |  | B. |  | C. |  | D. |  |
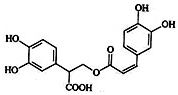 迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图.
迷迭香酸是从蜂花属植物中提取得到的酸性物质.其结构如图. 下列叙述正确的是( )
| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成反应 | |
| C. | 迷迭香酸可以发生加成反应、取代反应和酯化反应 | |
| D. | 迷迭香酸的化学式为C18H18O8 |
已知:①Cu2O+2H+=Cu+Cu2++H2O
②生成氢氧化物沉淀的pH:
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
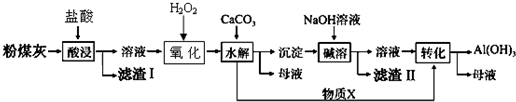
(2)验证煤粉灰含有FeO必要的化学试剂为稀硫酸、KMnO4溶液 (或稀盐酸、K3[Fe(CN)6]溶液).
(3)滤渣Ⅰ的主要成分为Cu、SiO2(填化学式),滤渣Ⅱ的主要成分为Fe (OH)3、Cu(OH)2(填化学式)
(4)物质X的化学式为CO2.“碱溶”时反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(5)为了获得产品Al(OH)3,从粉煤灰的盐酸浸取后的溶液开始,若只用CaCO3一种试剂,后续操作过程是加入CaCO3调节pH到3.2,过滤除去Fe(OH)3后,再加入CaCO3调节pH到5.2,过滤得到Al(OH)3_.

| A. | 工作时,电解质溶液中K+向负极移动 | |
| B. | 电路若有0.4mol电子通过,则消耗O2的量为0.2mol | |
| C. | 一段时间后溶液中OH-浓度将升高 | |
| D. | 正极反应式为:O2+4e-+2H2O═4OH- |
| A. | AgNO3 | B. | NaI | C. | NaOH | D. | AlCl3 |
 (1)如图为金刚烧的空间结构(碳架)
(1)如图为金刚烧的空间结构(碳架)
 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.