题目内容
10.下列实验“操作和现象”与“结论”对应关系正确的是操作和现象结论( )| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4后,在试管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有砖红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
| D | 向水玻璃溶液中通入足量CO2 后,产生白色浑浊 | 生成了硅酸沉淀 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.NO3-在酸性条件下具有氧化性,被还原生成NO,NO被O2氧化为红棕色的NO2;
B.葡萄糖在碱性条件下与新制Cu(OH)2浊液反应;
C.乙醇和浓硫酸反应制取乙烯的过程中,会有少量的SO2产生,SO2具有还原性,也可以使酸性KMnO4溶液褪色;
D.碳酸的酸性大于硅酸.
解答 解:A.向Fe(NO3)2溶液中加入H2SO4,则会发生离子反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,产生的NO在管口生成NO2呈现红色,而不是HNO3分解产生NO2,故A错误;
B.应加入碱将水解后的淀粉溶液调节成碱性,才可以产生红色沉淀,故B错误;
C.乙醇和浓硫酸反应制取乙烯的过程中,会有少量的SO2产生,也可以使酸性KMnO4溶液褪色,故C错误;
D.碳酸的酸性大于硅酸,强酸可制取弱酸,可生产硅酸沉淀,故D正确.
故选D.
点评 本题考查化学实验方案的评价,注意物质的性质和物质的检验方法,排除其它因素的干扰,注重相关基础知识的积累,难度不大.

练习册系列答案
相关题目
18. 青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( )
青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( )
 青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( )
青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( )| A. | 青蒿素能与热的NaOH溶液反应 | |
| B. | 青蒿素的分子式为C15H21O5 | |
| C. | 青蒿素分子结构中只含有极性键 | |
| D. | 青蒿素能使酸性KMnO4溶液、溴的CCl4溶液分别褪色 |
2.下列反应中生成物总能量高于反应物总能量的是( )
| A. | 盐酸与NaOH溶液反应 | B. | 碳酸氢铵受热分解 | ||
| C. | 铝粉与MnO2反应 | D. | 氧化钙溶于水 |
20.下列有关化学用语表示正确的是( )
| A. | 羟基的电子式: | B. | 乙炔的结构式:CHCH | ||
| C. | 硝基苯的结构简式: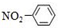 | D. | 甲烷分子的球棍模型: |



