题目内容
硫酸亚铁溶液中加入氢氧化钠溶液时,现象为 ,其化学方程式为 .
考点:铁的氧化物和氢氧化物
专题:元素及其化合物
分析:硫酸亚铁溶液中滴入氢氧化钠溶液,会生成氢氧化亚铁白色沉淀,氢氧化亚铁被空气中的氧气氧化为氢氧化铁,反应过程中出现灰绿色,最后变为红褐色,依此进行解答.
解答:
解:硫酸亚铁溶液中滴入氢氧化钠溶液,会生成氢氧化亚铁白色沉淀,发生反应:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,氢氧化亚铁被空气中的氧气氧化为氢氧化铁,发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,反应过程中出现灰绿色,最后变为红褐色,
故答案为:出现白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3.
故答案为:出现白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;FeSO4+2NaOH=Fe(OH)2↓+Na2SO4,4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题考查氢氧化亚铁和氢氧化铁的性质,题目难度不大.掌握物质性质和反应现象是解题关键.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
如图图示与对应叙述相符合的是( )
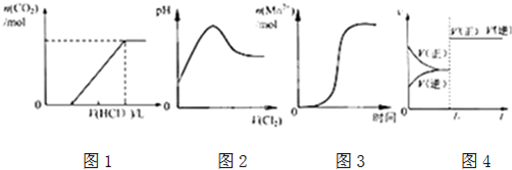

| A、图1表示在含等物质的量NaOH、Na2CO3的混合溶液中滴加0.1mol?L-1盐酸至过量时,产生气体的体积与消耗盐酸的关系 |
| B、图2表示Cl2通入H2S溶液中pH的变化 |
| C、图3表示10 mL 0.01 mol?L-1KMnO4 酸性溶液与过量的0.1 mol?L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化(Mn2+对该反应有催化作用) |
| D、图4表示已达平衡的某反应,在t0时改变某一条件后反应速率随时间变化,则改变的条件一定是加入催化剂 |
化学与环境、科学、技术密切相关.下列有关说法中正确的是( )
| A、煤经过气化和液化等物理变化可以转化为清洁燃料 |
| B、在海轮外壳上镶入锡块,可减缓船体的腐蚀速率 |
| C、光化学烟雾的形成与汽车尾气中的氮氧化物有关 |
| D、“鸟巢”使用钒氮合金钢,该合金熔点、硬度和强度均比纯铁高 |
 变色龙的外表随环境变化时一种生物的适应性,保护色在军事上用于进行“地表伪装”一直备受战争专家的青睐,BAFS是最近开发的芘系新型红外伪装还原染料,该染料为橄榄色或黑色,其化学结构如图,当n=3时,其一氯代物(不考虑醇羟基被取代)可能有( )
变色龙的外表随环境变化时一种生物的适应性,保护色在军事上用于进行“地表伪装”一直备受战争专家的青睐,BAFS是最近开发的芘系新型红外伪装还原染料,该染料为橄榄色或黑色,其化学结构如图,当n=3时,其一氯代物(不考虑醇羟基被取代)可能有( )| A、3种 | B、5种 | C、6种 | D、7种 |
在无色溶液中,下列离子能大量共存的是( )
| A、Na+、NH4+、NO3-、MnO4- |
| B、K +、SO42-、OH-、CO32- |
| C、K +、Fe3+、Cl-、Br- |
| D、Ba2+、Na+、OH-、CO32- |
取三张蓝色石蕊试纸放在玻璃棒上,然后按顺序分别摘加69% HNO3,98.3% H2SO4和新 制氯水,三张试纸最后呈现的颜色依次为( )
| A、白 红 白 |
| B、红 黑 红 |
| C、红 红 红 |
| D、白 黑 白 |
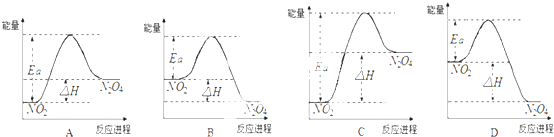
 研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.
研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题.