题目内容
(1)写出下列离子方程式相对应的化学方程式
①Ca2++CO32-=CaCO3↓化学方程式:
②Cu2++Fe=Fe2++Cu化学方程式:
(2)用一种试剂除去Na2SO4溶液中含有的CuSO4.写出所用试剂及离子方程式.
除杂试剂:
(3)鉴别饱和碳酸钠溶液和澄清石灰水
可选用鉴别的试剂有(多选,填编号)
A.盐酸 B.NaCl溶液 C.硝酸 D.BaCl2溶液
依次写出鉴别中有明显现象的反应的离子方程式:
①Ca2++CO32-=CaCO3↓化学方程式:
CaCl2+Na2CO3=CaCO3↓+2NaCl
CaCl2+Na2CO3=CaCO3↓+2NaCl
②Cu2++Fe=Fe2++Cu化学方程式:
CuSO4+Fe=FeSO4+Cu
CuSO4+Fe=FeSO4+Cu
(2)用一种试剂除去Na2SO4溶液中含有的CuSO4.写出所用试剂及离子方程式.
除杂试剂:
NaOH
NaOH
(用化学式表示),离子方程式:Cu2++2OH-=Cu(OH)2↓
Cu2++2OH-=Cu(OH)2↓
.(3)鉴别饱和碳酸钠溶液和澄清石灰水
可选用鉴别的试剂有(多选,填编号)
ACD
ACD
.A.盐酸 B.NaCl溶液 C.硝酸 D.BaCl2溶液
依次写出鉴别中有明显现象的反应的离子方程式:
CO32-+2H+=CO2↑+H2O
CO32-+2H+=CO2↑+H2O
;Ba2++CO32-=BaCO3↓
Ba2++CO32-=BaCO3↓
.分析:(1)①可溶性钙盐和可溶性碳酸盐反应生成碳酸钙和可溶性盐的离子反应为Ca2++CO32-=CaCO3↓;
②Fe与可溶性铜盐的离子反应为Cu2++Fe=Fe2++Cu;
(2)除去Na2SO4溶液中含有的CuSO4,选择NaOH将铜离子转化为沉淀;
(3)鉴别饱和碳酸钠溶液和澄清石灰水,可利用加酸生成气体的为碳酸钠,加氯化钡生成沉淀的为碳酸钠,以此来解答.
②Fe与可溶性铜盐的离子反应为Cu2++Fe=Fe2++Cu;
(2)除去Na2SO4溶液中含有的CuSO4,选择NaOH将铜离子转化为沉淀;
(3)鉴别饱和碳酸钠溶液和澄清石灰水,可利用加酸生成气体的为碳酸钠,加氯化钡生成沉淀的为碳酸钠,以此来解答.
解答:解:(1)①可溶性钙盐和可溶性碳酸盐反应生成碳酸钙和可溶性盐的离子反应为Ca2++CO32-=CaCO3↓,如CaCl2+Na2CO3=CaCO3↓+2NaCl,
故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl;
②Fe与可溶性铜盐的离子反应为Cu2++Fe=Fe2++Cu,如CuSO4+Fe=FeSO4+Cu,故答案为:CuSO4+Fe=FeSO4+Cu;
(2)除去Na2SO4溶液中含有的CuSO4,选择NaOH将铜离子转化为沉淀,发生的离子反应为Cu2++2OH-=Cu(OH)2↓,故答案为:NaOH;Cu2++2OH-=Cu(OH)2↓;
(3)鉴别饱和碳酸钠溶液和澄清石灰水,可利用加酸生成气体的为碳酸钠,加氯化钡生成沉淀的为碳酸钠,
加酸发生的离子反应为CO32-+2H+=CO2↑+H2O,加氯化钡发生的离子反应为Ba2++CO32-=BaCO3↓,故答案为:ACD;CO32-+2H+=CO2↑+H2O;Ba2++CO32-=BaCO3↓.
故答案为:CaCl2+Na2CO3=CaCO3↓+2NaCl;
②Fe与可溶性铜盐的离子反应为Cu2++Fe=Fe2++Cu,如CuSO4+Fe=FeSO4+Cu,故答案为:CuSO4+Fe=FeSO4+Cu;
(2)除去Na2SO4溶液中含有的CuSO4,选择NaOH将铜离子转化为沉淀,发生的离子反应为Cu2++2OH-=Cu(OH)2↓,故答案为:NaOH;Cu2++2OH-=Cu(OH)2↓;
(3)鉴别饱和碳酸钠溶液和澄清石灰水,可利用加酸生成气体的为碳酸钠,加氯化钡生成沉淀的为碳酸钠,
加酸发生的离子反应为CO32-+2H+=CO2↑+H2O,加氯化钡发生的离子反应为Ba2++CO32-=BaCO3↓,故答案为:ACD;CO32-+2H+=CO2↑+H2O;Ba2++CO32-=BaCO3↓.
点评:本题考查较综合,涉及离子反应的书写、物质的除杂、鉴别等,明确发生的化学反应为解答的关键,注意离子方程式的意义、除杂不能引入新杂质等,题目难度不大.

练习册系列答案
相关题目
 价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:
价电子(最外层电子)数和重原子(即比氢重的原子)数相同的分子(或离子)互称等电子体.等电子体的结构相似、物理性质相近,称为等电子原理.如N2和CO为等电子体,下表为部分元素等电子体的分类和空间构型表:| 等电子体类型 | 代表物质 | 空间构型 |
| 四原子24电子等电子体 | SO3 | 平面三角形 |
| 四原子26电子等电子体 | SO32- | 三角锥形 |
| 五原子32电子等电子体 | CCl4 | 四面体形 |
| 六原子40电子等电子体 | PCl5 | 三角双锥 |
| 七原子48电子等电子体 | SF6 | 八面体形 |
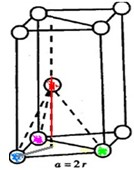 根据上述信息,回答下列问题:
根据上述信息,回答下列问题:(1)写出分子或离子的空间构型:IO3-
(2)由第一、二周期元素组成,与氧化性最强的单质分子互为等电子体的分子有N2H4
(3)如图是六方最密堆积(Be、Mg、Zn)的晶胞图之一,如果金属镁的密度是ρ g/cm3,且假设镁原子是互相接触的刚性小球,
镁的相对原子质量为M,阿伏加德罗常数为NA,则镁原子的半径为

 Ni(CO)4(g) 该反应的△H
Ni(CO)4(g) 该反应的△H
 (1)写出实现下列变化的化学方程式,注明①②反应的类型.
(1)写出实现下列变化的化学方程式,注明①②反应的类型.
