题目内容
12.纽扣电池的两极材料分别为锌和氧化银,电解质溶液为KOH溶液.放电时两个电极反应分别为:Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-,下列说法不正确的是( )| A. | 锌是负极,氧化银是正极 | |
| B. | 锌发生氧化方应,氧化银发生还原反应 | |
| C. | 在电池放电过程中,电解质溶液的酸碱性基本保持不变 | |
| D. | 溶液中OH-向正极移动,K+、H+向负极移动 |
分析 A.原电池中,负极上失电子发生氧化反应、正极上得电子发生还原反应,根据电极反应式知,Zn发生氧化反应为负极、氧化银发生还原反应为正极;
B.失电子发生氧化反应、得电子发生还原反应;
C.电池反应式为Ag2O+H2O+Zn=Zn(OH)2+2Ag,随着反应进行,电解质溶液浓度增大;
D.放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动.
解答 解:A.原电池中,负极上失电子发生氧化反应、正极上得电子发生还原反应,根据电极反应式知,Zn发生氧化反应为负极、氧化银发生还原反应为正极,故A正确;
B.锌失电子发生氧化反应、氧化银得电子发生还原反应,故B正确;
C.电池反应式为Ag2O+H2O+Zn=Zn(OH)2+2Ag,随着反应进行,消耗水,KOH的物质的量不变,则电解质溶液浓度增大,所以碱性增强,故C错误;
D.放电时,电解质溶液中阳离子向正极移动、阴离子向负极移动,所以溶液中OH-向负极移动,K+、H+向正极移动,故D错误;
故选CD.
点评 本题考查化学电源新型电池,侧重考查原电池原理,明确正负极判断、离子移动方向、反应类型即可解答,易错选项是C,注意KOH的物质的量不变但浓度改变.

练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
2.PbO2受热分解为Pb的+4和+2价的混合氧化物,+4价的Pb能氧化浓盐酸生成Cl2;现将1mol PbO2加热分解得到O2,向剩余固体中加入足量的浓盐酸得到Cl2,O2和Cl2的物质的量之比为1:1,则剩余固体的组成及物质的量比可能是( )
| A. | 1:2:1混合的PbO2、Pb3O4、PbO | B. | 1:3:2混合的PbO2、Pb3O4、PbO | ||
| C. | 1:1:1混合的PbO2、Pb3O4、PbO | D. | 2:1:1混合的PbO2、Pb3O4、PbO |
3.不能作为判断硫、氯两种元素非金属性强弱的依据是( )
| A. | 单质氧化性的强弱 | |
| B. | 氢化物沸点的高低 | |
| C. | 氢化物还原性强弱 | |
| D. | 最高价氧化物对应的水化物酸性的强弱 |
20.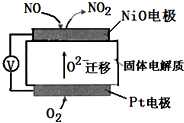 通过 NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法正确的是( )
通过 NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法正确的是( )
 通过 NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法正确的是( )
通过 NOx传感器可监测NOx的含量,其工作原理示意图如下,下列说法正确的是( )| A. | Pt 电极上发生的是氧化反应 | |
| B. | O2-向正极迁移 | |
| C. | 负极的电极反应式为:NO-2e-+O2-=NO2 | |
| D. | 正极的电极反应式为:O2+2H2O+4e-=4OH- |
4.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.据此,下列说法不正确的是( )


| A. | 该硫酸的物质的量浓度为18.4 mol•L-1 | |
| B. | 该硫酸与等体积的水混合后所得溶液的质量分数大于49% | |
| C. | 配制200mL 4.6 mol•L-1的稀硫酸需取该硫酸50mL | |
| D. | 该硫酸与等质量的水混合后所得溶液的物质的量浓度大于9.2 mol•L-1 |
1.如表陈述Ⅰ和Ⅱ均正确并且有因果关系的是( )
| 选项 | 陈述I | 陈述II |
| A | SO2有氧化性 | SO2能使酸性KMnO4溶液褪色 |
| B | SiO2导电能力强 | 可用于制造通讯光缆 |
| C | Al有还原性,在某些反应中热效应大 | 利用铝热反应冶炼金属Mn |
| D | 常温下铁与浓硫酸、浓硝酸均不反应 | 可用铁槽车密封运送浓硫酸、浓硝酸 |
| A. | A | B. | B | C. | C | D. | D |
2.在电解水制取H2和O2时,为了增强溶液的导电性,常常要加入一些电解质,最好选用下列物质中的( )
| A. | HCl | B. | Na2SO4 | C. | CuSO4 | D. | NaCl |
 铁、铝及其化合物在生产和生活中有着广泛的应用.
铁、铝及其化合物在生产和生活中有着广泛的应用.