题目内容
11.古代的很多成语、谚语都蕴含着很多科学知识,下列对成语、谚语的解释正确的是( )| A. | “爆竹声中除旧岁,春风送暖入屠苏.”爆竹爆炸发生的是分解反应 | |
| B. | “甘之如饴”说明糖类均有甜味 | |
| C. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| D. | “忽闻海上有仙山,山在虚无缥缈间”的海市蜃楼是一种自然现象,与胶体知识有关 |
分析 A.“爆竹声中除旧岁,春风送暖入屠苏”是炸药的爆炸;
B.淀粉和纤维素没有甜味;
C.“玉不琢不成器”只是玉的形状改变;
D.海市蜃楼与光线在空气中的折射有关,而空气属于胶体.
解答 解:A.“爆竹声中除旧岁,春风送暖入屠苏”是炸药的爆炸,属于氧化还原反应,不是分解反应,故A错误;
B.淀粉和纤维素属于糖类,但没有甜味,故B错误;
C.“玉不琢不成器”只是玉的形状改变,是物理变化,故C错误;
D.空气属于胶体,海市蜃楼是光线在延直线方向密度不同的气层中,经过折射造成的结果,故D正确;
故选D.
点评 本题考查物质组成、结构和性质的关系,题目难度不大,明确常见元素及其化合物组成、性质及用途为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
20.化学与生活、社会发展息息相关,下列说法不正确的是( )
| A. | “甘之如饴”说明糖类均有甜味 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “霾尘积聚难见路人”,雾霾所形成的气溶胶具有丁达尔效应 | |
| D. | 古剑“以剂钢为刃,柔铁为茎干,不尔则多断折”,剂钢指的是铁的合金 |
6.下列实验所用试剂、现象和结论均正确的是( )
| 序号 | 相关实验 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO4 | 盐酸、澄清的石灰水 | 产生无色无味气体,能使澄清的石灰水变浑浊的是K2CO3 |
| ② | 鉴别NO2和Br2蒸气 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸气 |
| ③ | 鉴别葡萄糖和蔗糖 | 银氨溶液 | 有银镜产生的葡萄糖 |
| ④ | 将装满氯水的圆底烧瓶倒置在有氯水的水槽中,日光照射 | -- | 烧瓶内有气泡产生,说明日光照射导致溶解的Cl2逸出 |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ②③ |
16.提出杂化轨道理论的科学家是( )
| A. | 泡利 | B. | 洪特 | C. | J•K罗林 | D. | 鲍林 |
19.设NA为阿伏加徳罗常数的值,下列说法不正确的是( )
| A. | 9.2gNO2和N2O4的混合物中含氮原子数目为0.2NA | |
| B. | 常温常压下,35.5g Cl2与足量的NaOH溶液完全反应,转移的电子数为0.5NA | |
| C. | 标准状况下,2.24LNH3与1.6gCH4分子中所含电子数目均为NA | |
| D. | 已知反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,当生成NA个NH3分子时,反应放出的热量小于46.2kJ |
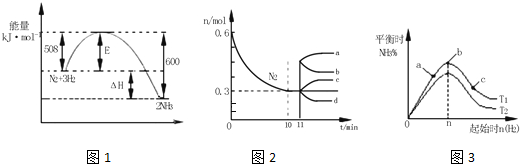
18.化学反应原理是工业合成氨的重要理论基础.
(1)合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,若在恒温、恒压条件下向平衡体系中通入氩气,平衡向左移动(填“向左”、“向右”或“不”);使用催化剂该反应的△H不变(填“增大”、“减小”或“不变”).
(2)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
下列说法正确的是BD(填字母编号).
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.a1+a3<1
(3)合成氨在等容条件下进行.改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图1所示:

①N2的平均反应速率vI(N2)、vII(N2)、vIII(N2)从大到小排列次序为vI(N2)>vII(N2)>vIII(N2).
②由第一次平衡到第二次平衡,平衡移动的方向是正向移动,采取的措施是降低了生成物浓度或分离出NH3.
③比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低:T2>T3(填“>”、“=”或“<”),判断的理由是此反应为放热反应,降低温度,平衡向正反应方向移动,平衡的移动只能减弱改变,不能抵消改变.
(4)将0.1mol N2和0.3mol H2通入一容积可变的容器中进行工业固氮反应.
①若300℃、压强P2时达到平衡,容器容积恰为10L,则此状态下反应的平衡常数K=22.6(mol•L-1)-2(计算结果保留3位有效数字).
②合成氨反应达到平衡后,t1时刻速率发生如图B变化,此刻可能改变的反应条件是加压或缩小容器体积或增大反应物浓度(回答一种).
(1)合成氨反应:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1,若在恒温、恒压条件下向平衡体系中通入氩气,平衡向左移动(填“向左”、“向右”或“不”);使用催化剂该反应的△H不变(填“增大”、“减小”或“不变”).
(2)在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:
| 容器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 1mol N2、3mol H2 | 2mol NH3 | 4mol NH3 |
| 平衡时NH3的浓度(mol•L-1) | cl | c2 | c3 |
| 反应的能量变化 | 放出a kJ | 吸收bkJ | 吸收c kj |
| 体系压强(pa) | p1 | p2 | p3 |
| 反应物转化率 | a1 | a2 | a3 |
A.2c1>c3 B.a+b=92.4 C.2p2<p3 D.a1+a3<1
(3)合成氨在等容条件下进行.改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图1所示:

①N2的平均反应速率vI(N2)、vII(N2)、vIII(N2)从大到小排列次序为vI(N2)>vII(N2)>vIII(N2).
②由第一次平衡到第二次平衡,平衡移动的方向是正向移动,采取的措施是降低了生成物浓度或分离出NH3.
③比较第II阶段反应温度(T2)和第III阶段反应温度(T3)的高低:T2>T3(填“>”、“=”或“<”),判断的理由是此反应为放热反应,降低温度,平衡向正反应方向移动,平衡的移动只能减弱改变,不能抵消改变.
(4)将0.1mol N2和0.3mol H2通入一容积可变的容器中进行工业固氮反应.
①若300℃、压强P2时达到平衡,容器容积恰为10L,则此状态下反应的平衡常数K=22.6(mol•L-1)-2(计算结果保留3位有效数字).
②合成氨反应达到平衡后,t1时刻速率发生如图B变化,此刻可能改变的反应条件是加压或缩小容器体积或增大反应物浓度(回答一种).