��Ŀ����
����Ŀ��Ϊ�ⶨijH2C2O4��Һ��Ũ�ȣ�ȡ����Һ����ƿ�У���������ϡH2SO4����Ũ��Ϊc mol/L KMnO4����Һ�ζ���
��1���ζ�ԭ��Ϊ���������ӷ���ʽ��ʾ����
��2���ζ�ʱ��KMnO4��ҺӦװ�������ʽ����ʽ�����ζ����У��ﵽ�ζ��յ�ʱ������Ϊ ��
��3����ͼ��ʾ50mL�ζ�����Һ���λ�ã���ʱ�ζ�����Һ��Ķ���ΪmL��
��4��Ϊ�˼�Сʵ������ͬѧһ������������ʵ�飬����ÿ����ȡH2C2O4��Һ�����ΪVmL������ʵ������¼���£�
ʵ����� | ��һ�� | �ڶ��� | ������ |
����KMnO4��Һ���/mL | 26.32 | 25.35 | 25.30 |
���ϱ����Կ�������һ��ʵ���м�¼����KMnO4��Һ��������Զ��ں����Σ���ԭ�������
A.ʵ�����ʱ���ӿ̶��߶�ȡ�ζ��յ�ʱKMnO4��Һ�������
B.�ζ�ǰ�ζ��ܼ��������ݣ��ζ����������ݣ�
C.��һ�εζ�ʢװ��Һ�ĵζ���װҺǰ������ˮ��ϴ����δ�ñ�Һ��ϴ�������ξ��ñ�Һ��ϴ��
D.��һ�εζ��õ���ƿ�ô�װҺ��ϴ����������δ��ϴ��
E.�μ�KMnO4��Һ���죬δ������տ�����Һ��ɫ������ֹͣ�ζ���
��5�������������ݣ�д������H2C2O4�����ʵ���Ũ�ȵı���ʽ�����ػ���C=mol/L��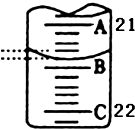
���𰸡�
��1��6H++2MnO4��+5H2C2O4�T2Mn2++10CO2��+8H2O
��2����ʽ,���������һ��KMnO4��Һʱ,��Һ����ɫ��Ϊ��ɫ,�Ұ�����ڲ���ɫ
��3��21.40
��4��B,C,D
��5��![]()
���������⣺��1��H2C2O4������KMnO4��Һ����������ԭ��Ӧ��H2C2O4��������CO2��KMnO4����ԭ��Mn2+����Ӧ�����ӷ���ʽΪ��6H++2MnO4��+5H2C2O4�T2Mn2++10CO2��+8H2O��
���Դ��ǣ�6H++2MnO4��+5H2C2O4�T2Mn2++10CO2��+8H2O��
��2����ΪKMnO4����ǿ�����ԣ��ḯʴ�ܣ���Ӧ����ʽ�ζ���ʢװ��KMnO4��Һ����ɫ�����ᷴӦ��ϣ����������һ��KMnO4��Һʱ����Һ����ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ������ζ��յ㣻
���Դ��ǣ���ʽ�����������һ��KMnO4��Һʱ����Һ����ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ��
��3��A��C�̶ȼ����1ml��˵��ÿ����С��֮����0.10mL��A���Ŀ̶�Ϊ21��A��B֮�����ĸ�С���������0.40mL����B��21.40mL��
���Դ��ǣ�21.40��
��4��A��ʵ�����ʱ���ӿ̶��߶�ȡ�ζ��յ�ʱKMnO4��Һ�������Һ��ƫ�ߣ�����ƫС������KMnO4���ƫС����A����
B���ζ�ǰ�ζ��ܼ��������ݣ��ζ����������ݣ�����KMnO4���ƫ��B��ȷ��
C����һ�εζ�ʢװ��Һ�ĵζ���װҺǰ������ˮ��ϴ����δ�ñ�Һ��ϴ�������ξ��ñ�Һ��ϴ��KMnO4Ũ��ƫС������KMnO4���ƫ��C��ȷ��
D����һ�εζ��õ���ƿ�ô�װҺ��ϴ����������δ��ϴ����ϴ��ƿ���²�������ʵ���ƫ����KMnO4���ƫ��D��ȷ��
E���μ�KMnO4��Һ���죬δ������տ�����Һ��ɫ������KMnO4���ƫС����E����
��ѡ��BCD��
��5�����εζ�����KMnO4��Һ����ֱ�Ϊ��26.32mLmL��25.35mL��25.30mL����һ�����ϴ���ȥ��mLmLmL����KMnO4��Һƽ�����Ϊ ![]() ������KMnO4���ʵ���Ϊn��KMnO4��=cmol/L��
������KMnO4���ʵ���Ϊn��KMnO4��=cmol/L�� ![]() ����2KMnO4+5H2C2O4+3H2SO4�TK2SO4+2MnSO4+10CO2��+8H2O��֪��n��H2C2O4��=
����2KMnO4+5H2C2O4+3H2SO4�TK2SO4+2MnSO4+10CO2��+8H2O��֪��n��H2C2O4��= ![]() n��KMnO4��=
n��KMnO4��= ![]() ��cmol/L��
��cmol/L�� ![]() ��������Ũ��Ϊ
��������Ũ��Ϊ  ��
��
���Դ��ǣ� ![]() ��
��
�����㾫����������Ҫ����������к͵ζ������֪ʶ�㣬��Ҫ�����к͵ζ�ʵ��ʱ��������ˮϴ���ĵζ������ñ�Һ��ϴ����װ��Һ�����ô���Һ��ϴ������ȡҺ�壻�ζ��ܶ���ʱ�ȵ�һ�����Ӻ��ٶ������۲���ƿ����Һ��ɫ�ĸı�ʱ���ȵȰ������ɫ�����Ϊ�ζ��յ������ȷ�����⣮

 �Ƹ�С״Ԫ�������������ϵ�д�
�Ƹ�С״Ԫ�������������ϵ�д�
