题目内容
将Na2O2投入FeCl2溶液中,可观察到的现象是( )
| A、生成白色沉淀、有气泡产生 |
| B、生成浅绿色沉淀、有气泡产生 |
| C、生成红褐色沉淀、有气泡产生 |
| D、没有沉淀生成 |
考点:钠的重要化合物
专题:元素及其化合物
分析:Na2O2投入FeCl2溶液反应中Na2O2和水反应,生成的氢氧化钠和氧气,氢氧化钠再与氯化亚铁反应生成氢氧化亚铁,氢氧化亚铁被氧化为氢氧化铁.
解答:
解:将Na2O2投入FeCl2溶液中,发生的反应为:2Na2O2+2H2O=4NaOH+O2↑,2NaOH+FeCl2=Fe(OH)2↓+2NaCl,4Fe(OH)2+O2+H2O=4Fe(OH)3,4Fe(OH)2是白色沉淀易被氧化为红褐色的Fe(OH)3沉淀,所以看到的现象是:有大量气泡生成,出现白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色.
故选C.
故选C.
点评:本题考查钠化合物的性质、氢氧化钠的性质,为高频考点,侧重于元素化合物知识的综合理解和运用的考查,正确分析反应过程是解本题的关键,经常考查的还有Na2O2、Na投入CuSO4溶液中观察到的现象.

练习册系列答案
相关题目
某兴趣小组为探究外界条件对可逆反应A(g)+B(g)═C(g)+D(s)的影响,进行了如下实验:恒温条件下,往一个容积为10L的密闭容器中充入1mol A和1mol B,反应达平衡时测得容器中各物质的浓度为Ⅰ.然后改变不同条件做了另三组实验,重新达到平衡时容器中各成分的浓度分别为Ⅱ、Ⅲ、Ⅳ.
针对上述系列实验,下列结论中错误的是( )
| A | B | C | |
| Ⅰ | 0.050mol?L-1 | 0.050mol?L-1 | 0.050mol?L-1 |
| Ⅱ | 0.070mol?L-1 | 0.070mol?L-1 | 0.098mol?L-1 |
| Ⅲ | 0.060mol?L-1 | 0.060mol?L-1 | 0.040mol?L-1 |
| Ⅳ | 0.080mol?L-1 | 0.080mol?L-1 | 0.12mol?L-1 |
| A、由Ⅰ中数据可计算出该温度下反应的平衡常数K=20mol-1?L |
| B、Ⅱ可能是通过增大C的浓度实现的 |
| C、若Ⅲ只是升高温度,则与Ⅰ比较,可以判断出正反应一定是放热反应 |
| D、第Ⅳ组实验数据的得出,只能通过压缩容器的体积才可以实现 |
液氨是富氢物质,是氢能的理想载体,利用N2+3H2?2NH3实现储氢和输氢.下列说法不正确的是( )
| A、NH3分子中N原子采用sp3杂化 |
| B、因为NH3的相对分子质量比PH3小,所以相同压强时,NH3沸点比PH3低 |
| C、[Cu (NH3)4]2+离子中,N原子是配位原子 |
| D、CN-的电子式为[:C┇┇N:]- |
化学与生活密切相关,下列说法正确的是( )
| A、二氧化硫广泛用于食品的漂白 |
| B、生活中使用的塑料食品盒、水杯等通常由聚苯乙烯制成,其单体的分子式为C8H10 |
| C、合成纤维,人造纤维及碳纤维都属于有机高分子材料 |
| D、先通入氯气,再加入硫酸亚铁处理水,能达到消毒杀菌和除去悬浮杂质的目的 |
在一定温度下,可逆反应:X(气)+3Y(气)?2Z(气)达到反应限度的是( )
| A、X、Y、Z的浓度相等 |
| B、X、Y、Z的分子数比为1:3:2 |
| C、Z的生成速率是X的生成速率的二倍 |
| D、单位时间内生成n mol X,同时生成3n mol Y |
下列说法不正确的是( )
| A、生铁、不锈钢和黄金都属于合金 |
| B、水泥、玻璃、陶瓷均属于无机非金属材料 |
| C、淀粉、油脂、蛋白质都属于天然高分子化合物 |
| D、天然气、石油液化气和汽油的主要成分都属于烃类 |
一些微生物在代谢过程中会产生硫化物.科学家设计出利用一种菌种生成的硫化物,与氧气构成微生物燃料电池,电解质溶液呈酸性.下列关于该电池的说法不正确的是( )
| A、将化学能转化为电能电池 |
| B、放电时,H+向正极移动 |
| C、正极反应式为:O2+2H2O+4e-═4OH- |
| D、负极反应式可能为:S2-+4H2O-8e-═SO42-+8H+ |

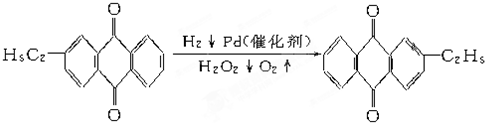
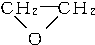 +CaCl2+H2O,则制备
+CaCl2+H2O,则制备 工艺的原子利用率为
工艺的原子利用率为