ћвƒњƒЏ»Ё
°Њћвƒњ°њћЉ°Ґµ™°ҐЅтЉ∞∆дїѓЇѕќпґ‘…ъ≤ъ°Ґ…ъїо”–÷Ў“™µƒ“в“е°£
(1)“‘![]() ”л
”л![]() ќ™‘≠Ѕѕњ…Їѕ≥…ƒтЋЎ°£“—÷™£Ї
ќ™‘≠Ѕѕњ…Їѕ≥…ƒтЋЎ°£“—÷™£Ї
Ґў![]()
![]()
ҐЏ![]()
![]()
Ґџ![]()
![]()
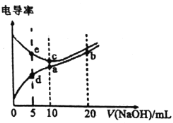
–і≥цNH3ЇЌCO2Їѕ≥…ƒтЋЎЇЌ“ЇћђЋЃµƒ»»їѓ—ІЈљ≥ћ љ________°£
(2)Єяќ¬ѕ¬£ђCO2”л„гЅњµƒћЉ‘Џ√№±’»Ё∆ч÷– µѕ÷Јі”¶£Ї![]() °£ѕт»Ёїэќ™1LµƒЇг»Ё»Ё∆ч÷–Љ”»л0.2molCO2£ђ‘Џ≤їЌђќ¬ґ»ѕ¬іпµљ∆љЇв ±CO2µƒќп÷ µƒЅњ≈®ґ»Ћжќ¬ґ»µƒ±дїѓ»зЌЉЋщ Њ°£‘тЄ√Јі”¶ќ™________(ћо°∞Ј≈»»°±їт°∞ќь»»°±)Јі”¶£їƒ≥ќ¬ґ»ѕ¬»фѕтЄ√∆љЇвћеѕµ÷–‘ўЌ®»л0.2molCO2£ђіпµљ–¬∆љЇвЇу£ђћеѕµ÷–COµƒ∞ўЈ÷ЇђЅњ________(ћо°∞±діу°±°Ґ°∞±д–°°±їт°∞≤ї±д°±)°£
°£ѕт»Ёїэќ™1LµƒЇг»Ё»Ё∆ч÷–Љ”»л0.2molCO2£ђ‘Џ≤їЌђќ¬ґ»ѕ¬іпµљ∆љЇв ±CO2µƒќп÷ µƒЅњ≈®ґ»Ћжќ¬ґ»µƒ±дїѓ»зЌЉЋщ Њ°£‘тЄ√Јі”¶ќ™________(ћо°∞Ј≈»»°±їт°∞ќь»»°±)Јі”¶£їƒ≥ќ¬ґ»ѕ¬»фѕтЄ√∆љЇвћеѕµ÷–‘ўЌ®»л0.2molCO2£ђіпµљ–¬∆љЇвЇу£ђћеѕµ÷–COµƒ∞ўЈ÷ЇђЅњ________(ћо°∞±діу°±°Ґ°∞±д–°°±їт°∞≤ї±д°±)°£
(3)“їґ®Ѕњµƒ![]() ”л„гЅњµƒћЉ‘Џћеїэњ…±дµƒЇг—є√№±’»Ё∆ч÷–Јі”¶£Ї
”л„гЅњµƒћЉ‘Џћеїэњ…±дµƒЇг—є√№±’»Ё∆ч÷–Јі”¶£Ї![]() £ђ∆љЇв ±ћеѕµ÷–∆шћећеїэЈ÷ э”лќ¬ґ»µƒєЎѕµ»зЌЉЋщ Њ£Ї
£ђ∆љЇв ±ћеѕµ÷–∆шћећеїэЈ÷ э”лќ¬ґ»µƒєЎѕµ»зЌЉЋщ Њ£Ї
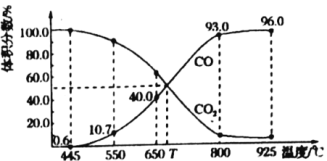
Ґў650°ж ±£ђЈі”¶іп∆љЇвЇу![]() µƒ„™їѓ¬ ќ™________°£
µƒ„™їѓ¬ ќ™________°£
ҐЏ![]() °ж ±£ђ∆љЇв≥£ э
°ж ±£ђ∆љЇв≥£ э![]() ________
________![]() (”√∆љЇвЈ÷—єіъћж∆љЇв≈®ґ»Љ∆Ћг£ђЈ÷—є
(”√∆љЇвЈ÷—єіъћж∆љЇв≈®ґ»Љ∆Ћг£ђЈ÷—є![]() „№—є
„№—є![]() ћеїэЈ÷ э)°£
ћеїэЈ÷ э)°£
(4)![]() ”л
”л![]() ƒ№ЈҐ…ъЈі”¶£Ї
ƒ№ЈҐ…ъЈі”¶£Ї![]()
![]() ‘Џєћґ®ћеїэµƒ√№±’»Ё∆ч÷–£ђ є”√ƒ≥÷÷іяїѓЉЅ£ђЄƒ±д‘≠Ѕѕ∆ш≈д±»љш––ґаіќ µ—й(Єчіќ µ—йµƒќ¬ґ»њ…ƒ№ѕаЌђ£ђ“≤њ…ƒ№≤їЌђ)£ђ≤вґ®
‘Џєћґ®ћеїэµƒ√№±’»Ё∆ч÷–£ђ є”√ƒ≥÷÷іяїѓЉЅ£ђЄƒ±д‘≠Ѕѕ∆ш≈д±»љш––ґаіќ µ—й(Єчіќ µ—йµƒќ¬ґ»њ…ƒ№ѕаЌђ£ђ“≤њ…ƒ№≤їЌђ)£ђ≤вґ®![]() µƒ∆љЇв„™їѓ¬ °£≤њЈ÷ µ—йљбєы»зЌЉЋщ Њ£Ї
µƒ∆љЇв„™їѓ¬ °£≤њЈ÷ µ—йљбєы»зЌЉЋщ Њ£Ї
Ґўµ±»Ё∆чƒЏ________(ћо±кЇ≈)≤ї‘ўЋж ±Љдµƒ±дїѓґшЄƒ±д ±£ђЈі”¶іпµљ∆љЇв„іћђ°£
A£Ѓ∆шћеµƒ—є«њ B£Ѓ∆шћеµƒ∆љЊщƒ¶ґы÷ Ѕњ C£Ѓ∆шћеµƒ√№ґ» D£Ѓ![]() µƒћеїэЈ÷ э
µƒћеїэЈ÷ э
ҐЏ»зєы“™љЂЌЉ÷–Cµгµƒ∆љЇв„іћђЄƒ±дќ™Bµгµƒ∆љЇв„іћђ£ђ”¶≤…»°µƒіл © «________°£
Ґџ»фAµгґ‘”¶ µ—й÷–£ђ![]() µƒ∆р Љ≈®ґ»ќ™
µƒ∆р Љ≈®ґ»ќ™![]() £ђЊ≠єэ
£ђЊ≠єэ![]() іпµљ∆љЇв„іћђ£ђЄ√ ±ґќїѓ—ІЈі”¶Ћў¬
іпµљ∆љЇв„іћђ£ђЄ√ ±ґќїѓ—ІЈі”¶Ћў¬ ![]() ________
________![]() °£
°£
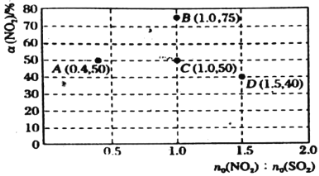
Ґ№ЌЉ÷–C°ҐDЅљµгґ‘”¶µƒќ¬ґ»Ј÷±рќ™![]() °жЇЌ
°жЇЌ![]() °ж£ђЌ®єэЉ∆Ћг≈–ґѕ
°ж£ђЌ®єэЉ∆Ћг≈–ґѕ![]() ________
________![]() (ћо°∞
(ћо°∞![]() °±°Ґ°∞
°±°Ґ°∞![]() °±їт°∞
°±їт°∞![]() °±)°£
°±)°£
°Њір∞Є°њ![]()
![]() ќь»» ±д–° 25% 0.5 D љµµЌќ¬ґ»
ќь»» ±д–° 25% 0.5 D љµµЌќ¬ґ» ![]()
![]()
°Њљвќц°њ
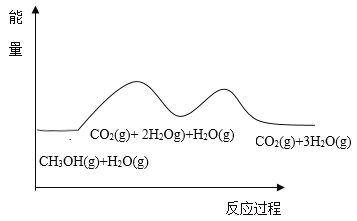
±Њћв„џЇѕњЉ≤мЄ«Ћєґ®¬…ЇЌїѓ—І∆љЇв≥£ эµƒЉ∆Ћг£ђїѓ—І∆љЇв≥£ эµƒЉ∆Ћг≥£”√»эґќ љјіљш––Љ∆Ћг£ђґ‘”ЏЈі”¶![]() £ђ”√∆љЇвЈ÷—єіъћж∆љЇв≈®ґ»Љ∆Ћгµƒїѓ—І∆љЇв≥£ эµƒ±ніп љќ™£Ї
£ђ”√∆љЇвЈ÷—єіъћж∆љЇв≈®ґ»Љ∆Ћгµƒїѓ—І∆љЇв≥£ эµƒ±ніп љќ™£Ї![]() °£
°£
(1)ЄщЊЁЄ«Ћєґ®¬…Љ∆Ћг£®1£©+£®2£©-£®3£©µ√![]() ”л
”л![]() Їѕ≥…ƒтЋЎµƒ»»їѓ—ІЈљ≥ћ љќ™£Ї
Їѕ≥…ƒтЋЎµƒ»»їѓ—ІЈљ≥ћ љќ™£Ї![]() £ї
£ї![]() £ђє ±Њћвір∞Єќ™£Ї
£ђє ±Њћвір∞Єќ™£Ї![]() £ї
£ї![]() °£
°£
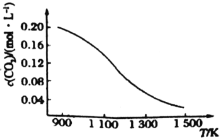
(2)Ћж„≈ќ¬ґ»µƒ…эЄя£ђCO2µƒќп÷ µƒЅњ≈®ґ»÷рљ•Љх–°£ђЋµ√ч∆љЇв’эѕт“∆ґѓ£ђ“тіЋЄ√Јі”¶ ф”Џќь»»Јі”¶£їЇг»Ё»Ё∆ч÷–≥д»лґю—хїѓћЉњ…“‘њі„ц£ђґю—хїѓћЉѕ»”лћЉ‘Џ∆дЋы»Ё∆чЈі”¶іпµљ∆љЇвЇу£ђ‘ўїмЇѕ∞—ћеїэЋх–°÷Ѕ‘≠ Љћеїэ£ђѕаµ±”Џ‘ціу—є«њ£ђ‘т∆љЇвѕтƒжЈі”¶Јљѕтљш––£ђіпµљ–¬∆љЇвЇу£ђћеѕµ÷–COµƒ∞ўЈ÷ЇђЅњЉх–°£ђє ±Њћвір∞Єќ™£Їќь»»£ї±д–°£ї
(3)”…ЌЉњ…“‘÷™µј£ђ650°ж ±£ђЈі”¶іпµљ∆љЇвЇуCOµƒћеїэЈ÷ эќ™40%£ђ…ињ™ ЉЈі”¶ ±Љ”»лµƒґю—хїѓћЉќ™1mol£ђ„™їѓЅЋx mol£ђ‘т”–£Ї

Ћщ“‘![]() £ђЉ∆Ћг≥цx=0.25mol£ђ‘тґю—хїѓћЉµƒ„™їѓ¬ ќ™25%£ї
£ђЉ∆Ћг≥цx=0.25mol£ђ‘тґю—хїѓћЉµƒ„™їѓ¬ ќ™25%£ї
![]() °ж ±£ђ“ї—хїѓћЉЇЌґю—хїѓћЉµƒћеїэЈ÷ эЊщќ™50%£ђ ‘т
°ж ±£ђ“ї—хїѓћЉЇЌґю—хїѓћЉµƒћеїэЈ÷ эЊщќ™50%£ђ ‘т![]() £ђє ±Њћвір∞Єќ™£Ї25%£ї0.5£ї
£ђє ±Њћвір∞Єќ™£Ї25%£ї0.5£ї
(4) ҐўA£ђЈі”¶«∞Їу∆шћеќп÷ µƒЅњ≤ї±д£ђ∆шћеµƒ—є«њ Љ÷’≤ї±д£ђ≤їƒ№Ћµ√чЈі”¶іпµљ∆љЇв„іћђ£ђє Aінќу£ї
B°Ґ∆шће÷ Ѕњ≤ї±д£ђ∆шћеќп÷ µƒЅњ≤ї±д£ђ∆шћеµƒ∆љЊщƒ¶ґы÷ Ѕњ Љ÷’≤ї±д£ђ≤їƒ№Ћµ√чЈі”¶іпµљ∆љЇв„іћђ£ђє Bінќу£ї
C°ҐЈі”¶«∞Їу∆шће÷ Ѕњ≤ї±д∆шћећеїэ≤ї±д£ђ∆шћеµƒ√№ґ» Љ÷’≤ї±д£ђ≤їƒ№Ћµ√чЈі”¶іпµљ∆љЇв„іћђ£ђє Cінќу£ї
D°ҐNO2µƒћеїэЈ÷ э≤ї±д «∆љЇв±к÷Њ£ђє D’э»Ј£ї“тіЋ£ђ±Њћв’э»Јір∞Є «£ЇD£ї
ҐЏ»зєы“™љЂЌЉ÷–Cµгµƒ∆љЇв„іћђЄƒ±дќ™Bµгµƒ∆љЇв„іћђ£ђ∆љЇв„™їѓ¬ ‘ціу£ђ∆љЇв’эѕтљш––£ђ’эЈі”¶ќ™Ј≈»»Јі”¶£ђљµµЌќ¬ґ»∆љЇв’эѕтљш––£ђ“тіЋ£ђ±Њћв’э»Јір∞Є «£ЇљµµЌќ¬ґ»£ї
ҐџAµг∆љЇв„™їѓ¬ ќ™50%£ђn(NO2)£Їn(SO2)=0.4£ђSO2(g)µƒ∆р Љ≈®ґ»ќ™comol /L£ђNO2∆р Љ≈®ґ»c(NO2)=0.4 comol /L£ђЈі”¶µƒґю—хїѓµ™≈®ґ»=0. 4comol/ L°Ѕ50%=0.2comol/L£ђЄ√ ±ґќїѓ—ІЈі”¶Ћў¬ V(NO2)=![]() =
=![]() mol/Lmin£ђ“тіЋ£ђ±Њћв’э»Јір∞Є «£Ї
mol/Lmin£ђ“тіЋ£ђ±Њћв’э»Јір∞Є «£Ї![]() £ї
£ї
(4 NO2(g)+SO2(g)![]() SO3(g)+NO(g)£ђ°чH=-41.8kJ/mol£ђЈі”¶ќ™Ј≈»»Јі”¶£ђn(NO2)£Їn(SO2)=1£ђSO2(g)µƒ∆р Љ≈®ґ»ќ™comol/L£ђc(NO2)= comol/L£ђЌЉ÷–C°ҐDЅљµгґ‘”¶µƒ µ—йќ¬ґ»Ј÷±рќ™TcЇЌTd£ђCµгґю—хїѓµ™„™їѓ¬ ќ™50%£ђ
SO3(g)+NO(g)£ђ°чH=-41.8kJ/mol£ђЈі”¶ќ™Ј≈»»Јі”¶£ђn(NO2)£Їn(SO2)=1£ђSO2(g)µƒ∆р Љ≈®ґ»ќ™comol/L£ђc(NO2)= comol/L£ђЌЉ÷–C°ҐDЅљµгґ‘”¶µƒ µ—йќ¬ґ»Ј÷±рќ™TcЇЌTd£ђCµгґю—хїѓµ™„™їѓ¬ ќ™50%£ђ

∆љЇв≥£ эK=1°£
Dµгґю—хїѓћЉµƒ„™їѓ¬ ќ™40%£ђn(NO2)£Їn(SO2)=1.5£ђSO2(g)µƒ∆р Љ≈®ґ»ќ™comol/L£ђc(NO2)= 1.5comol/L£ђ‘т

∆љЇв≥£ эK=1°£
∆љЇв≥£ эѕаЌђ£ђЋµ√чЈі”¶ќ¬ґ»ѕаЌђ£ђTc=Td£ђ“тіЋ£ђ±Њћв’э»Јір∞Є£Ї=°£

 „÷і Њд∆™”лЌђ≤љ„чќƒіп±кѕµЅ–ір∞Є
„÷і Њд∆™”лЌђ≤љ„чќƒіп±кѕµЅ–ір∞Є