题目内容
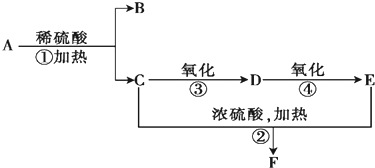
10.若将溶液中含有的Fe3+、Al3+、Ba2+离子逐一沉淀分离出来,其正确的实验步骤是( )①加入过量Na2CO3;
②加入过量Na2SO4;
③加入过量Ba(OH)2;
④加入过量NaOH;
⑤通入足量CO2;
⑥过滤.
| A. | ①⑥③⑥⑤⑥ | B. | ②⑥③⑥⑤⑥ | C. | ①⑥④⑥⑤⑥ | D. | ②⑥④⑥⑤⑥ |
分析 可首先加入Na2SO4,生成硫酸钡沉淀,除去Ba2+,然后加入过量NaOH,生成氢氧化铁沉淀,过滤后在滤液中通入二氧化碳,可生成氢氧化铝沉淀,以此解答.
解答 解:可首先加入Na2SO4,生成硫酸钡沉淀,除去Ba2+,过量后加入过量NaOH,生成氢氧化铁沉淀,过滤后在滤液中通入二氧化碳,可生成氢氧化铝沉淀,则顺序为①⑥④⑥⑤⑥,
故选C
点评 本题考查混合物的分离、提纯,侧重除杂和分离的考查,把握物质的化学性质为解答本题的关键,注意把握除杂的顺序,易错点为D,注意每次只生成一种沉淀,题目难度不大.

练习册系列答案
相关题目
1.锌作为人体必须的微量元素之一,当人体缺锌时,经常用补食硫酸锌的方式调整.工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意图如下:
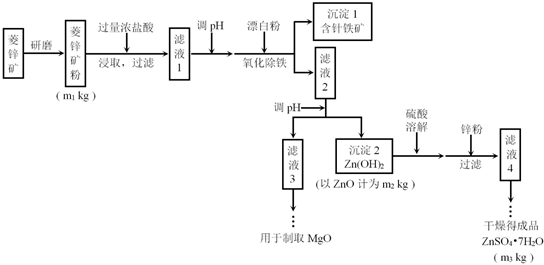
(1)加过量稀盐酸的目的是提高锌元素的浸出率.
(2)完成“氧化除铁”步骤中反应的离子方程式:
2Fe(OH)2+ClO-+H2O═2Fe(OH)3+1Cl-
(3)针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是FeO(OH).
(4)根据下表数据,调节“滤液 2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4.
(5)工业上从“滤液3”制取MgO过程中,最适合的反应物是b(选填序号).
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(7)分析流程图中的数据,菱锌矿粉中ZnCO3的质量分数不低于$\frac{125m2}{81m1}$×100%.

(1)加过量稀盐酸的目的是提高锌元素的浸出率.
(2)完成“氧化除铁”步骤中反应的离子方程式:
2Fe(OH)2+ClO-+H2O═2Fe(OH)3+1Cl-
(3)针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是FeO(OH).
(4)根据下表数据,调节“滤液 2”的pH时,理论上可选用的最大区间为8.0≤pH<10.4.
| Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 | |
| 开始沉淀的pH | 10.4 | 6.4 | - | - |
| 沉淀完全的pH | 12.4 | 8.0 | - | - |
| 开始溶解的pH | - | 10.5 | - | - |
| Ksp | 5.6×10-12 | - | 6.8×10-6 | 2.8×10-9 |
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(7)分析流程图中的数据,菱锌矿粉中ZnCO3的质量分数不低于$\frac{125m2}{81m1}$×100%.
5.下列说法 不正确的是( )
| A. | 易燃试剂与强氧化试剂分开放置并远离火源 | |
| B. | 用湿润的红色石蕊试纸检验氨气 | |
| C. | 在50ml量筒中配制0.1000mol•L-1硫酸钠 | |
| D. | 实验室酒精灯着火时,用湿抹布覆盖灭火 |
15.一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40mol/L盐酸中,充分反应后产生896mL H2(标准状况),残留固体1.28g.过滤,滤液中无Cu2+.将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L.下列判断正确的是( )
| A. | 残留固体中一定不含有铁 | B. | 滤液中可能含有Fe3+ | ||
| C. | 原混合物中n(Fe)=n(Fe2O3)+n(CuO) | D. | 原混合物中铁为3.36 g |
19.三国时代,诸葛亮领兵南征孟获,遇到了“哑泉”,士兵饮后致哑,腹痛,甚至死亡.又有一“安乐泉”饮后可解“哑泉”之毒.1995年10月国内某报刊报道,经科研人员研究,“哑泉”水中溶有CuSO4,“安乐泉”水质偏碱性.下列有关说法可能符合题意的是( )
| A. | “哑泉”之毒是由于水中的Cu2+使人体中的蛋白质分解 | |
| B. | “哑泉”之毒是由于水中的SO42-使人体中的蛋白质变性 | |
| C. | “哑泉”之毒是由于水中的Cu2+水解显酸性使人体中的蛋白质变性 | |
| D. | “安乐泉”能解“哑泉”之毒的离子方程式为Cu2++2OH-=Cu(OH)2↓ |
20.如图所示与对应叙述相符合的是( )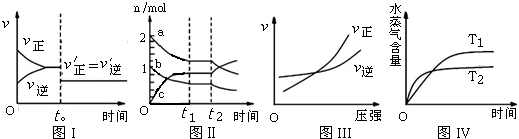

| A. | 图I:反应H2+I2═2HI 达平衡后,t0时降低温度反应速率随时间的变化 | |
| B. | 图Ⅱ:反应2SO3═2SO2+O2 达平衡后,扩大容器体积时各成分的物质的量随时间的变化(图中a、b、c分别代表SO2、O2、SO3的物质的量的变化曲线) | |
| C. | 图III:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 | |
| D. | 图IV:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
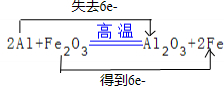
 ,它是由Na+与O22-(填写离子符号)构成的.
,它是由Na+与O22-(填写离子符号)构成的.