��Ŀ����
13���Թ�ҵ̼��ƣ�������Na+��A13+��Fe3+�����ʣ�����ҽ�ö�ˮ���Ȼ��ƾ��壨CaCl2•2H2O����������Ϊ97.3-99.3%���Ĺ�������Ϊ
��1����ҵ̼����������ܽ�֮ǰҪ�����ϸ������Ŀ�����ӷ�Ӧ�Ӵ������
��2��CaCO3�����ᷴӦ�����ӷ���ʽCaCO3+2H+=Ca2++CO2��+H2O��
��3���ټ�������������Һ������Һ��PHΪ8.0-8.5����ʱA13+��Fe3+������ȫ����������Ҫ�ɷֵĻ�ѧʽAl��OH��3��Fe��OH��3��
�ڹ���ʱ���õIJ����������ձ��������������ͨ©����
���� �Թ�ҵ̼���̼�������ҽ�ö�ˮ���Ȼ��ƾ��壺̼��������ᷴӦ��CaCO3+2HCl�TCaCl2+H2O+CO2������Һ�к���Ca2+��Na+��A13+��Fe3+��Cl-�����ӣ������������ƣ�������Һ��PHΪ8.0-8.5��������Fe3++3OH-�TFe��OH��3����A13++3OH-�TA1��OH��3�������ˣ�������Ҫ�ɷ�Ϊ��Al��OH��3��Fe��OH��3���������ữ��ͨ������Ũ������ȴ�ᾧ�����ˣ�ϴ�ӣ��������Ȼ��ƾ��壮
��1�������ϸ������Ŀ��Ϊ����Ӵ��������Ӧ���ʣ�
��2��̼��ƿ��Ժ����ᷢ����Ӧ�����Ȼ��ơ�ˮ�Լ�������̼��
��3���ٸ������Ρ����ε����������лش����κͼӦ���������������������κͼӦ������������������
�ڸ��ݹ��˵IJ������̺�������װ���ж��õ�ʲô������
��� �⣺�Թ�ҵ̼���̼�������ҽ�ö�ˮ���Ȼ��ƾ��壺̼��������ᷴӦ��CaCO3+2HCl�TCaCl2+H2O+CO2������Һ�к���Ca2+��Na+��A13+��Fe3+��Cl-�����ӣ������������ƣ�������Һ��PHΪ8.0-8.5��������Fe3++3OH-�TFe��OH��3����A13++3OH-�TA1��OH��3�������ˣ�������Ҫ�ɷ�Ϊ��Al��OH��3��Fe��OH��3���������ữ��ͨ������Ũ������ȴ�ᾧ�����ˣ�ϴ�ӣ��������Ȼ��ƾ��壮
��1���������ԽС����ѧ��Ӧ����Խ�죬ͬʱ��ʹ��Ԫ�ؾ����ܶ���ܽ���У��ʴ�Ϊ�����ӷ�Ӧ�Ӵ������
��2��̼��������ᷢ�����ֽⷴӦ����Ӧ�ķ���ʽΪ��CaCO3+2HCl�TCaCl2+H2O+CO2�������ӷ���ʽΪCaCO3+2H+=Ca2++CO2��+H2O��
�ʴ�Ϊ��CaCO3+2H+=Ca2++CO2��+H2O��
��3���ټ�������������Һ������Һ��pHΪ8.0-8.5����ʱ������Fe3++3OH-�TFe��OH��3����A13++3OH-�TA1��OH��3����Al3+��Fe3+������ȫ���γ��������������������������ʴ�Ϊ��Al��OH��3��Fe��OH��3��
����ʱ��Ҫ��������������ͨ©�����̶�����������̨�������õIJ��������н���Һ���ձ������Թ���ʱ���õIJ����������ձ��������������ͨ©����
�ʴ�Ϊ����ͨ©����
���� ������һ���й�ʵ�鷽����ƺ����ʵķ�����ᴿ֪ʶ���ۺϿ����⣬����ʵ���ԭ���Ͳ��������������ͼ��Ϣ�ǽ����Ĺؼ�����Ŀ�Ѷ��еȣ�

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�| A�� |  ��Һ����� | B�� | 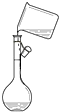 ת����Һ | C�� | 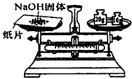 ��ȡNaOH���� | D�� | 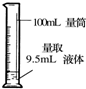 ��ȡҺ�� |
| A�� | 1��16 | B�� | 16��1 | C�� | 17��7 | D�� | 5��7 |

| ��ѧʽ | NH3•H2O | HCN | CH3COOH | H2CO3 |
| ����ƽ�ⳣ����25�棩 | Kb=1.77��10-5 | Ka=4.93��10-10 | Ka=1.76��10-5 | Ka1=4.30��10-7 Ka2=5.61��10-11 |
��2������ˮ��̶ȵ�ǿ��ͬ����������ʵĵ���̶���һ����ϵ����ϱ������ݻش��������⣺
��25��ʱ���е�Ũ�ȵ�a��NaCN��Һ��b��Na2CO3��Һ��c��CH3COONa��Һ��������Һ��pH�ɴ�С��˳��Ϊb��a��c��������Һǰ��ţ�
��Ũ����ͬ��NaCN��Һ��CH3COOK��Һ��ȣ�c��Na+��-c��CN-����c��K+��-c��CH3COO-���������������������=����
�۽�����������ʵ���Ũ�ȵ�����Ͱ�ˮ��Ϻ���Һ�����ԣ���ᡱ��������С����������ӷ���ʽ��ʾԭ��NH4++H2O?NH3•H2O+H+
�������£�����0.1mol•L-1�������20mL 0.1mol•L-1��ˮ�У���ҺpH�������������ı仯��������ͼ��ʾ��b����ʾ��Һ�е�������NH3•H2O��NH4Cl
��NH4HCO3��Һ�ʼ��ԣ���ᡱ��������С���
��3����ϱ������ݣ���NaCN��Һ��ͨ������CO2����������Ӧ�Ļ�ѧ����ʽNaCN+H2O+CO2=HCN+NaHCO3��
| A�� | 0.22 g CO2 | B�� | 3.6 g H2O | C�� | 3.2 g O2 | D�� | 73 g HCl |
 ij�����£���2L�ܱ������з������·�Ӧ��2NO2��g��?2NO��g��+O2��g���������ֲ�ͬ�����½��У�����ʵ�����800�棬ʵ�����850�棬NO��O2����ʼŨ�ȶ�Ϊ0��NO2��Ũ�ȣ�mol•L-1����ʱ�䣨min���ı仯��ͼ��ʾ����ش��������⣺
ij�����£���2L�ܱ������з������·�Ӧ��2NO2��g��?2NO��g��+O2��g���������ֲ�ͬ�����½��У�����ʵ�����800�棬ʵ�����850�棬NO��O2����ʼŨ�ȶ�Ϊ0��NO2��Ũ�ȣ�mol•L-1����ʱ�䣨min���ı仯��ͼ��ʾ����ش��������⣺
 ʵ������ȡ�����������װ����ͼ��ʾ�������������������գ�
ʵ������ȡ�����������װ����ͼ��ʾ�������������������գ�