题目内容
对常温下pH=3的CH3COOH溶液,下列叙述不正确的是( )
| A、c(H+)=c(CH3COO-)+c(OH-) |
| B、加入少量CH3COONa固体后,c(CH3COO-)降低 |
| C、该溶液中由水电离出的c(H+)是1.0×10-11mol/L |
| D、与等体积pH=11的NaOH溶液混合后所得溶液显酸性 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:醋酸为弱酸,醋酸溶液中存在电离平衡CH3COOH?H++CH3COO-,则pH=3的CH3COOH溶液,c(H+)=0.001mol/L,c(CH3COOH)>0.001mol/L,以此解答该题.
解答:
解:A.醋酸溶液呈电中性,溶液中存在电荷守恒c(H+)=c(OH-)+c(CH3COO-),故A正确;
B.加入少量CH3COONa固体后,虽然平衡向逆反应方向移动,但c(CH3COO-)增大,故B错误;
C.c(H+)=0.001mol/L,则c(OH-)=1.0×10-11mol/L,所以该溶液中由水电离出的c(H+)是1.0×10-11mol/L,故C正确;
D.等体积pH=11的NaOH溶液混合,醋酸过量,反应后溶液呈酸性,故D正确.
故选B.
B.加入少量CH3COONa固体后,虽然平衡向逆反应方向移动,但c(CH3COO-)增大,故B错误;
C.c(H+)=0.001mol/L,则c(OH-)=1.0×10-11mol/L,所以该溶液中由水电离出的c(H+)是1.0×10-11mol/L,故C正确;
D.等体积pH=11的NaOH溶液混合,醋酸过量,反应后溶液呈酸性,故D正确.
故选B.
点评:本题考查了弱电解质的电离,为高频考点,侧重于学生的分析能力的考查,注意把握溶液中存在电荷守恒,注意离子浓度大小的判断方法,难度中等.

练习册系列答案
相关题目
下列解释事实的离子方程式不正确的是( )
| A、氯化铜溶液显酸性:Cu2++2H2O?Cu(OH)2+2H+ |
| B、氯气使湿润的淀粉KI试纸变蓝:Cl2+2I-=2Cl-+I2 |
| C、向硫酸铝溶液中加入氨水出现白色胶状沉淀:Al3++3OH-?Al(OH)3↓ |
| D、实验室不用玻璃塞试剂瓶盛装氢氧化钠溶液:SiO2+2OH-?SiO32-+H2O |
用NA表示阿伏加德罗常数的值.下列叙述正确的是(相对原子质量:D-2 O-16 Cu-64)( )
| A、18g的D216O中含有的中子数为9NA |
| B、物质的量浓度均为1.0mol/L的硫酸与高氯酸(HClO4)溶液中含有的氧原子数均为4NA |
| C、33.6L NO2溶于足量的水得到的溶液中含有的NO3-数为NA |
| D、32g铜发生氧化还原反应,一定失去NA个电子 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、与Al反应放出H2的溶液:Mg2+、Ca2+、HCO3-、NO3- | ||
| B、10mol?L-1的浓氨水:Al3+、NH4+、NO3-、I- | ||
| C、0.1 mol?L-1KMnO4溶液:Na+、Fe2+、SO42-、Cl- | ||
D、
|

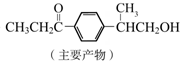 +HCl
+HCl
 与1分子
与1分子  也可以发生类似反应①的反应,有机化合物结构简式为
也可以发生类似反应①的反应,有机化合物结构简式为 近年来,碳和碳的化合物在生产生活实际中应用广泛.
近年来,碳和碳的化合物在生产生活实际中应用广泛. 合成氨工业的核心反应是N2(g)+3H2(g)
合成氨工业的核心反应是N2(g)+3H2(g)