题目内容
11.下列操作方法中可行的是( )| A. | 用淀粉KI试纸鉴别溴蒸气和NO2气体 | |
| B. | 证明Fe2O3是碱性氧化物,可将其与盐酸混合,观察现象 | |
| C. | 若NaOH溶液不慎沾到皮肤上,应该立即用大量的硫酸清洗 | |
| D. | 除去MnO2中的杂质KMnO4,可将固体溶于水后过滤 |
分析 A.二者都可氧化KI生成碘;
B.能与酸反应生成盐和水的氧化物不一定为碱性氧化物;
C.硫酸也具有腐蚀性;
D.高锰酸钾可溶于水,而二氧化锰不溶于水.
解答 解:A.溴蒸气和NO2气体都可氧化KI生成碘,都可使淀粉KI试纸变蓝色,不能检验,应用水或硝酸银溶液,故A错误;
B.能与酸反应生成盐和水的氧化物不一定为碱性氧化物,故氧化铝,故B错误;
C.若NaOH溶液不慎沾到皮肤上,应用大量的水冲洗,在涂上硼酸稀溶液,不能用硫酸,故C错误;
D.高锰酸钾可溶于水,而二氧化锰不溶于水,可用溶解、过滤的方法分离,故D正确.
故选D.
点评 本题考查物质的检验、鉴别和分离、提纯,为高考常见题型,侧重考查学生的分析能力和实验能力,注意把握物质的性质的异同以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
2.常温下,用0.1mol/L的盐酸滴定a mL NaOH稀溶液.反应恰好完全时,消耗盐酸b mL.此时溶液时中c (OH-)是( )
| A. | 1.0×10-7 mol/L | B. | 1.0×107 mol/L | C. | $\frac{0.1}{a}$mol/L | D. | $\frac{0.1b}{a+b}$mol/L |
19.2016年世界环境日,我国环保部公布中国主题为“改善环境质量,推动绿色发展”.下列做法与该主题相违背的是( )
| A. | 推广和鼓励多使用公共交通工具出行 | |
| B. | 植树造林,绿化环境 | |
| C. | 利用廉价煤炭,大力发展火力发电 | |
| D. | 对燃煤进行脱硫,减少空气的污染 |
6.化学与人类生活、生产、环境密切相关,下列有关说法不正确的是( )
| A. | 雾霾可能是许多细小液体小液滴和固体小颗粒分散到空气中形成的一种胶体 | |
| B. | 我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型有机高分子材料 | |
| C. | “84”消毒液主要成分为次氯酸钠,与适量白醋混合使用消毒效果会更好 | |
| D. | 夏季马路喷洒氯化钙溶液,氯化钙跟水分子结合形成结晶水合物起到保湿作用 |
16.国外宇航员吃着“牙膏和砖块”时,中国宇航员已经在太空泡茶了,每个茶装在特制包装袋中,注水后用加热器进行加热就可以喝了,但要插上吸管以防止水珠飘起来,下列说法正确的是( )
| A. | 字航员喝茶时注入的H2O的摩尔质量是18克 | |
| B. | H2O+Cl2?HCl+HClO这反应属于氧化还原反应 | |
| C. | 氢的三种同位素1H、2D、3T与18O只能形成三种水分子 | |
| D. | 在标准状况下,1mol水的体积约是22.4L |
1.实验化学实验室通常用粗锌和稀硫酸反应制氢气,因此在制氢废液中含有大量的硫酸锌.同时,由于粗锌中还含有铁等杂质,使得溶液中混有一定量的硫酸亚铁,为了充分利用制氢废液,常用其制备皓矾(ZnSO4•7H2O).某校化学兴趣小组的同学以制氢气的废液为原料来制取皓矾并探究其性质.
(l)制备皓矾的实验流程如图所示.
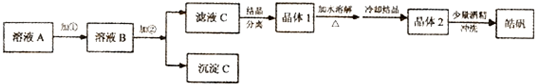
已知:下列氢氧化物开始生成沉淀到沉淀完全的pH范围分别为:
回答下列问题:
可供选择使用的有:氯水、20%的H2O2、氨水、NaOH溶液、Zn(OH)2、ZnO
①加入的试剂①,应选用20%的H2O2,发生反应的离子方程式为2H++H2O2+2Fe2+=2Fe3++2H2O
②加入的试剂②,可选用ZnO或Zn(OH)2,其作用是调节溶液的pH至3.7-5.7,使Fe3+完全转化为Fe(OH)3沉淀,同时避免引入新的杂质
③从晶体l→晶体2,该提纯过程的名称是重结晶.
④有同学提出,应将晶体1加入稀硫酸中溶解,请结合离子方程式解析Zn2++2H2O?Zn(OH)2+2H+,稀硫酸可抑制ZnSO4的水解,防止产生Zn(OH)2杂质.
⑤在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是为了冲洗掉晶体表面残留的滤液,防止晶体溶解,影响产率.
(2)检验皓矾中是否含有Fe元素的操作(试剂自选)取少量皓矾溶于水配制成溶液,往所得溶液中滴加适量KSCN溶液,如无明显现象说明不含Fe3+,如溶液变为红色则说明含Fe3+.
(l)制备皓矾的实验流程如图所示.

已知:下列氢氧化物开始生成沉淀到沉淀完全的pH范围分别为:
| 开始沉淀 | 沉淀完全 | |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Zn(OH)2 | 5.7 | 8.0 |
可供选择使用的有:氯水、20%的H2O2、氨水、NaOH溶液、Zn(OH)2、ZnO
①加入的试剂①,应选用20%的H2O2,发生反应的离子方程式为2H++H2O2+2Fe2+=2Fe3++2H2O
②加入的试剂②,可选用ZnO或Zn(OH)2,其作用是调节溶液的pH至3.7-5.7,使Fe3+完全转化为Fe(OH)3沉淀,同时避免引入新的杂质
③从晶体l→晶体2,该提纯过程的名称是重结晶.
④有同学提出,应将晶体1加入稀硫酸中溶解,请结合离子方程式解析Zn2++2H2O?Zn(OH)2+2H+,稀硫酸可抑制ZnSO4的水解,防止产生Zn(OH)2杂质.
⑤在得到皓矾时,向晶体中加入少量酒精洗涤而不用水的原因是为了冲洗掉晶体表面残留的滤液,防止晶体溶解,影响产率.
(2)检验皓矾中是否含有Fe元素的操作(试剂自选)取少量皓矾溶于水配制成溶液,往所得溶液中滴加适量KSCN溶液,如无明显现象说明不含Fe3+,如溶液变为红色则说明含Fe3+.
19.下列各物质的同分异构体中,能形成顺、反异构体的是( )
| A. | 1,1-二氯乙烯 | B. | 丙烯 | C. | 1-丁烯 | D. | 2-戊烯 |