��Ŀ����
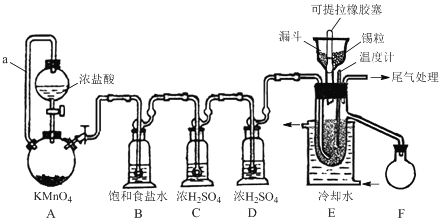
����Ŀ��ʵ���ҿ��������������Ʊ���ˮ���Ȼ�����SnCl4����SnCl4�ӷ���������ˮ�⣬Cl2��������SnCl4���Ʊ�ԭ����ʵ��װ��ͼ���£�
Sn(s)+2Cl2(g)=SnCl4(l) ��H = �C511kJmol��1
�����õ����й��������£�
���� | Sn | SnCl4 | CuCl2 |
�۵�/�� | 232 | -33 | 620 |
�е�/�� | 2260 | 114 | 993 |
�Ʊ������У����������ģ�������������ʱ��Ӧ���в�����������SnCl4Һ��������ڸ߶�ʱ��Һ̬���ᆳ����������ƿ���ش��������⣺
��1��a�ܵ�������________��
��2��A�з�Ӧ�����ӷ���ʽ��________��
��3��D��������________��
��4��E����ȴˮ��������________��
��5��β������ʱ����ѡ�õ�װ����________������ţ���
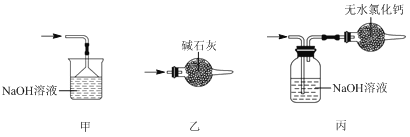
��6�������к�ͭ������E�в���CuCl2������Ӱ��F�в�Ʒ�Ĵ��ȣ�ԭ����________��
��7��SnCl4��Ʒ�к���Cl2������ʱ����������м������ɵô�����SnCl4����������в���Ҫ�õ���������________������ţ���
A��������ƿ B���¶ȼ� C�������� D�������� E������ƿ
���𰸡�ƽ��ѹǿ��ʹŨ�����ܹ�˳������ 2MnO4��+10Cl��+16H+=2Mn2++5Cl2��+8H2O ʹ������ָ��� �������Ȼ�����������ʧ�����²����½� �� CuCl2�۵�ϸߣ����������Ȼ���Һ����� E
��������
��1��a�ܽ���Һ©��Һ��������ͨ����ƽ��ѹǿ��ʹŨ�����ܹ�˳�����µ����ã�
��2��A�еķ�ӦΪ������غ�Ũ��������������Ӧ�����Ȼ��̡��Ȼ��ء�������ˮ�������غ��ϵ��ƽ��д�����ӷ���ʽ��
��3��DΪʢ��Ũ�����ϴ��ƿ������������������������Ϣ��֪��SnCl4������ˮ�⣬��D��������ʹ������ָ��
��4������Ϣ��֪��SnCl4�ӷ�����E����ȴˮ�������DZ������Ȼ�����������ʧ�����²����½���
��5��β������ʱ��ѡ�õ�װ���в���ʹ��ˮ��Һ����Ϊˮ��������E��ʹSnCl4����ˮ�⣻
��6���ɱ������ݿ�֪��CuCl2�۵�ϸߣ����������Ȼ���Һ����������������к�ͭ������E�в���CuCl2������Ӱ��F�в�Ʒ�Ĵ��ȣ�
��7�������������Ҫ�õ���������������ƿ���¶ȼơ������ܺͽ��������Դ˷�����
��1��a�ܽ���Һ©��Һ��������ͨ����ƽ��ѹǿ��ʹŨ�����ܹ�˳�����µ����ã�
�ʴ�Ϊ��ƽ��ѹǿ��ʹŨ�����ܹ�˳�����£�
��2��A�еķ�ӦΪ������غ�Ũ��������������Ӧ�����Ȼ��̡��Ȼ��ء�������ˮ�����ӷ���ʽΪ2MnO4��+10Cl��+16H+=2Mn2++5Cl2��+8H2O��
�ʴ�Ϊ��2MnO4��+10Cl��+16H+=2Mn2++5Cl2��+8H2O��
��3��DΪʢ��Ũ�����ϴ��ƿ������������������������Ϣ��֪��SnCl4������ˮ�⣬��D��������ʹ������ָ��
�ʴ�Ϊ��ʹ������ָ��
��4������Ϣ��֪��SnCl4�ӷ�����E����ȴˮ�������DZ������Ȼ�����������ʧ�����²����½���
�ʴ�Ϊ���������Ȼ�����������ʧ�����²����½���
��5��β������ʱ��ѡ�õ�װ���в���ʹ��ˮ��Һ����Ϊˮ��������E��ʹSnCl4����ˮ�⣬�ʲ�ѡ�ס�����Ӧѡ�ң�
�ʴ�Ϊ���ң�
��6���ɱ������ݿ�֪��CuCl2�۵�ϸߣ����������Ȼ���Һ����������������к�ͭ������E�в���CuCl2������Ӱ��F�в�Ʒ�Ĵ��ȣ�
�ʴ�Ϊ��CuCl2�۵�ϸߣ����������Ȼ���Һ�������
��7�������������Ҫ�õ���������������ƿ���¶ȼơ������ܺͽ���������������ƿ���ʲ�ѡE��
�ʴ�Ϊ��E��