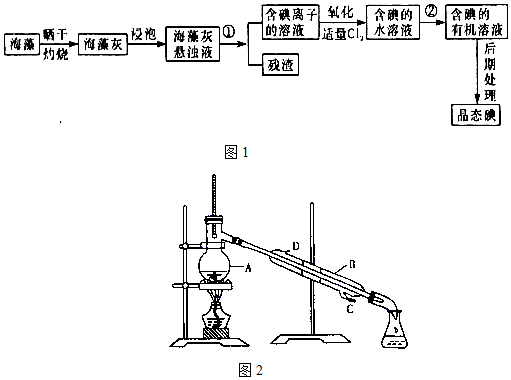
题目内容
15.具有下列分子式的一氯代烷中,水解后产物在红热铜丝催化下,最多可被空气氧化生成四种不同的醛的是( )| A. | C4H9Cl | B. | C3H7Cl | C. | C6H13Cl | D. | C5H11Cl |
分析 先确定烷烃的对称中心,即找出等效的氢原子,再根据先中心后外围的原则,将溴原子逐一去代替氢原子,有几种氢原子就有几种一溴代烃,溴原子只有连接在键端的碳原子上水解生成的醇,且该碳上有氢原子,才能被氧化成醛,据此即可解答.
解答 解:先确定烷烃的一溴代物的种类,然后,溴原子只有连接在键端的碳原子上水解生成的醇,且该碳上有氢原子,才能被氧化成醛.
A.正丁烷两种一溴代物,异丁烷两种一溴代物,共4种,所以分子式为C4H9Br的同分异构体共有4种,其中溴原子连接在键端的碳原子上能被氧化成醛的只有1-溴丁烷、1-溴-2-甲基丙烷,故A错误;
B.C3H7Br水解生成在键端的碳原子上的醇,且该碳上有氢原子的卤代烃为:CH3CH2CH2Br,被空气氧化生成1种醛:CH3CH2CHO,故B错误;
C.C6H14属于烷烃,主链为6个碳原子有:CH3(CH2)4CH3;主链为5个碳原子有:CH3CH2CH2CH(CH3)2;CH3CH2CH(CH3)CH2CH3;主链为4个碳原子有:CH3CH2C(CH3)3;CH3CH(CH3)CH(CH3)CH3,则相应的一取代物分别有3、5、4、3、2种.故分子式为C6H13-的同分异构体共有17种;最多可被空气氧化生成17种不同的醛,故C错误;
D.C5H11Br水解生成在键端的碳原子上的醇,且该碳上有氢原子的卤代烃为:CH3CH2CH2CH2CH2Br 1-溴戊烷;CH3CH2CH(CH3)CH2Br 2-甲基-1-溴丁烷;CH3CH(CH3)CH2CH2Br 3-甲基-1-溴丁烷;CH3C(CH3)2CH2Br 2,2-二甲基-1-溴丙烷;被空气氧化生成4种不同的醛为:CH3CH2CH2CH2CHO 戊醛;CH3CH2CH(CH3)CHO 2-甲基丁醛;CH3CH(CH3)CH2CHO 3-甲基丁醛;CH3C(CH3)2CHO 2,2-二甲基丙醛;故D正确;
故选D.
点评 本题考查同分异构体的应用和卤代烃的水解、醇的氧化等知识,可以根据所学知识来回答,题目难度中等.

(1)请配平以下化学方程式:
10Al+6NaNO3+4NaOH=10NaAlO2+3N2↑+2H2O
若反应过程中转移5mol电子,则生成标准状况下N2的体积为11.2L.
(2)25℃时,将a mol•L-1的氨水与0.1mol•L-1的盐酸等体积混合,当溶液中离子浓度关系满足c(NH4+)>c(Cl-)时,则反应的情况可能为a.
a.盐酸不足,氨水剩余b.氨水与盐酸恰好完全反应c.盐酸过量
(3)向NH4HSO4溶液中滴加少量的Ba(OH)2溶液的离子方程式2H++SO42-+Ba2++2OH-=BaSO4+2H2O.
(4)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②0.10mol•L-1Na2SO3溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+).
③H2SO3溶液和NaHCO3溶液混合,主要反应的离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
| A. | K+、Na+、Cl-、NO3- | B. | K+、NO3-、OH-、HCO3- | ||
| C. | Na+、Ca2+、Cl-、HCO3- | D. | SO42-、NH4+、S2-、Na+ |
| NaOH起始读数 | NaOH终点读数 | |
| 第一次 | 0.10ml | 20.30ml |
| 第二次 | 0.30ml | 20.10ml |
(2)在配制250mL0.20mol•L-1的氢氧化钠标准溶液时,用到的仪器除托盘天平、烧杯、玻璃棒还有250mL容量瓶、胶头滴管.
(3)以下操作造成测定结果偏高的有DE.
A.配制标准溶液的氢氧化钠固体中混有KOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
| A. | v(c)=0.2mol/(L•s) | B. | z=3 | ||
| C. | B的转化率为75% | D. | 反应前与2s后容器的压强比为4:3 |
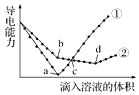 在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示.下列分析不正确的是( )| A. | c点,两溶液中含有相同量的OH- | |
| B. | b点,溶液中大量存在的离子是Na+、OH- | |
| C. | ①代表滴加H2SO4溶液的变化曲线 | |
| D. | a、d两点对应的溶液均显中性 |
| A. | 3C(s)+CaC(s)?CaC2 (s)+CO(g)在常温下不能自发进行,说明该反应的△H>0 | |
| B. | CH3COOH溶液加水稀释后,溶液中$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$的值增大 | |
| C. | 恒温恒压的密闭容器中进行反应:N2(g)+3H2(g)?2NH3(g)△H=-aKJ/mol,平衡时向容器中在充入一定量的NH3,重新达到平衡时a值不变 | |
| D. | C(s)+H2O(g)?CO(g)+H2(g) (△H>0),其它条件不变时,升高温度,正反应速率增大,逆反应速率减小,平衡正向移动 |