题目内容
短周期元素X.Y.Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1:1的离子化合物A,X与Z能形成原子个数比为1:1的共价化合物B,它们之间能实现如图1所示转化(部分产物已略去):
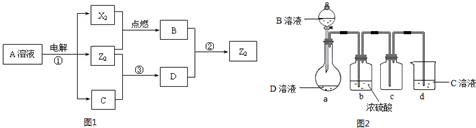
(1)Y在周期表的位置是 ;Z2的电子式是 .
(2)反应①的化学方程式是 .
(3)D溶液呈碱性的原因是(用离子方程式表示) ;
D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应.某校的学生在实验室利用反应②的原理来制备纯净.干燥的Z2,仪器装置如图2所示(夹持固定装置的仪器已略去).
I.写出反应②的离子方程式 .
Ⅱ.上述实验装置不够完善,改进方法是 .
(4)Z2跟C在常温时发生反应③,在加热条件下发生的反应是3Z2+6C
5A+YZO3+3H2O,
3mol Z2与足量的C溶液反应,转移电子的物质的量n(e-)的取值范围是 .

(1)Y在周期表的位置是
(2)反应①的化学方程式是
(3)D溶液呈碱性的原因是(用离子方程式表示)
D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应.某校的学生在实验室利用反应②的原理来制备纯净.干燥的Z2,仪器装置如图2所示(夹持固定装置的仪器已略去).
I.写出反应②的离子方程式
Ⅱ.上述实验装置不够完善,改进方法是
(4)Z2跟C在常温时发生反应③,在加热条件下发生的反应是3Z2+6C
| △ |
3mol Z2与足量的C溶液反应,转移电子的物质的量n(e-)的取值范围是
考点:位置结构性质的相互关系应用
专题:
分析:短周期元素X、Y、Z的原子序数依次增大,Y与Z能形成离子个数比为1:1的离子化合物A,电解A溶液可得X2、Z2单质及C,有三种物质生成,其中两种单质,为双原子分子,应为电解水与电解质型的电解,则A为盐溶液,该盐溶液盐的阳离子不能放电,酸根离子放电,则A可能为NaCl,则Y为钠元素,Z为氯元素;X和Y同主族,且X的原子序数较小,X与Z能形成原子个数比为1:1的共价化合物,则X为氢元素.
若A为NaCl,电解NaCl溶液可得H2、Cl2单质及NaOH,H2与Cl2反应生成HCl,即B为HCl,氯气能与氢氧化钠反应生成次氯酸钠,则X2 为H2,Z2为Cl2,次氯酸钠能与HCl反应生成氯气,故符合题意.
所以X为氢元素,Y为钠元素,Z为氯元素;X2 为H2,Z2为Cl2,B为HCl,C为NaOH,D为NaClO;
(1)Y为Na元素,在第三周期,第IA族;Z2为Cl2,各原子为8电子结构,原子间含有一个共用电子对;
(2)电解氯化钠溶液生成H2、Cl2及NaOH;
(3)氯气与氢氧化钠溶液反应生成的D为次氯酸钠;
I、反应②是盐酸与次氯酸钠反应;
II、没有除去氯气中的氯化氢;
(4)Cl2跟NaOH在常温时发生反应③,在加热条件下发生的反应是3Cl2+6NaOH
5NaCl+NaClO3+3H2O,若只发生该反应根据Cl2的物质的量求出转移电子,若只发生反应③,根据Cl2的物质的量求出转移电子,则转移电子的物质的量n(e-)在二者之间.
若A为NaCl,电解NaCl溶液可得H2、Cl2单质及NaOH,H2与Cl2反应生成HCl,即B为HCl,氯气能与氢氧化钠反应生成次氯酸钠,则X2 为H2,Z2为Cl2,次氯酸钠能与HCl反应生成氯气,故符合题意.
所以X为氢元素,Y为钠元素,Z为氯元素;X2 为H2,Z2为Cl2,B为HCl,C为NaOH,D为NaClO;
(1)Y为Na元素,在第三周期,第IA族;Z2为Cl2,各原子为8电子结构,原子间含有一个共用电子对;
(2)电解氯化钠溶液生成H2、Cl2及NaOH;
(3)氯气与氢氧化钠溶液反应生成的D为次氯酸钠;
I、反应②是盐酸与次氯酸钠反应;
II、没有除去氯气中的氯化氢;
(4)Cl2跟NaOH在常温时发生反应③,在加热条件下发生的反应是3Cl2+6NaOH
| ||
解答:
解:短周期元素X、Y、Z的原子序数依次增大,Y与Z能形成离子个数比为1:1的离子化合物A,电解A溶液可得X2、Z2单质及C,有三种物质生成,其中两种单质,为双原子分子,应为电解水与电解质型的电解,则A为盐溶液,该盐溶液盐的阳离子不能放电,酸根离子放电,则A可能为NaCl,则Y为钠元素,Z为氯元素;X和Y同主族,且X的原子序数较小,X与Z能形成原子个数比为1:1的共价化合物,则X为氢元素.
若A为NaCl,电解NaCl溶液可得H2、Cl2单质及NaOH,H2与Cl2反应生成HCl,即B为HCl,氯气能与氢氧化钠反应生成次氯酸钠,则X2 为H2,Z2为Cl2,次氯酸钠能与HCl反应生成氯气.故符合题意.
所以X为氢元素,Y为钠元素,Z为氯元素;X2 为H2,Z2为Cl2,B为HCl,C为NaOH,D为NaClO.
(1)Y为Na元素,原子核外有3个电子层,最外层有1个电子,处于周期表第三周期第IA族;Z2为Cl2,各原子为8电子结构,原子间含有一个共用电子对,其电子式是 ,故答案为:第三周期第IA族;
,故答案为:第三周期第IA族; ;
;
(2)反应①为电解氯化钠溶液,生成氢气、氯气与氢氧化钠,反应的化学方程式是2NaCl+2H2O
2NaOH+Cl2↑+H2↑,
故答案为:2NaCl+2H2O
2NaOH+Cl2↑+H2↑;
(3)I、反应②是盐酸与次氯酸钠反应,生成氯化钠、氯气与水,反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O,故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
II、由于盐酸具有挥发性,上述实验装置制取的氯气中含有氯化氢,应在a、b装置之间加一盛有饱和食盐水的洗气瓶,除去HCl,
故答案为:在a、b装置之间加一盛有饱和食盐水(或水)的洗气瓶,除去HCl;
(4)Cl2跟NaOH在常温时发生反应③Cl2+2NaOH=NaCl+NaClO+H2O,在加热条件下发生的反应是3Cl2+6NaOH
5NaCl+NaClO3+3H2O,若只发生该反应则3molCl2完全反应转移的电子为5mol;若只发生反应③,则3molCl2完全反应转移的电子为3mol,所以转移电子的物质的量n(e-)的取值范围是3 mol≤n(e-)≤5 mol,
故答案为:3 mol≤n(e-)≤5 mol.
若A为NaCl,电解NaCl溶液可得H2、Cl2单质及NaOH,H2与Cl2反应生成HCl,即B为HCl,氯气能与氢氧化钠反应生成次氯酸钠,则X2 为H2,Z2为Cl2,次氯酸钠能与HCl反应生成氯气.故符合题意.
所以X为氢元素,Y为钠元素,Z为氯元素;X2 为H2,Z2为Cl2,B为HCl,C为NaOH,D为NaClO.
(1)Y为Na元素,原子核外有3个电子层,最外层有1个电子,处于周期表第三周期第IA族;Z2为Cl2,各原子为8电子结构,原子间含有一个共用电子对,其电子式是
 ,故答案为:第三周期第IA族;
,故答案为:第三周期第IA族; ;
;(2)反应①为电解氯化钠溶液,生成氢气、氯气与氢氧化钠,反应的化学方程式是2NaCl+2H2O
| ||
故答案为:2NaCl+2H2O
| ||
(3)I、反应②是盐酸与次氯酸钠反应,生成氯化钠、氯气与水,反应的离子方程式为ClO-+Cl-+2H+=Cl2↑+H2O,故答案为:ClO-+Cl-+2H+=Cl2↑+H2O;
II、由于盐酸具有挥发性,上述实验装置制取的氯气中含有氯化氢,应在a、b装置之间加一盛有饱和食盐水的洗气瓶,除去HCl,
故答案为:在a、b装置之间加一盛有饱和食盐水(或水)的洗气瓶,除去HCl;
(4)Cl2跟NaOH在常温时发生反应③Cl2+2NaOH=NaCl+NaClO+H2O,在加热条件下发生的反应是3Cl2+6NaOH
| ||
故答案为:3 mol≤n(e-)≤5 mol.
点评:本题考查元素化合物的推断、电子式的书写、电解原理、离子方程式、氧化还原反应等,题目难度中等,关键是根据电解原理推断元素及相应化合物,侧重于考查学生对基础知识的综合应用能力.

练习册系列答案
相关题目
我国的“神州五号”载人飞船已发射成功,“嫦娥”探月工程已正式启动.据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量.在地球上,氦元素主要以42He的形式存在.下列说法正确的是( )
| A、42He原子核内含有4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、42He的最外层电子数为2,所以42He具有较强的金属性 |
中和热的测定实验中,可能用到下列仪器:①托盘天平 ②量筒 ③烧杯 ④温度计 ⑤小试管 ⑥酒精灯.其中应使用仪器的正确组合是( )
| A、①②⑤ | B、②③④ |
| C、②③⑥ | D、全部 |
化学工作者从有机反应RH+Cl2(g)═RCl(l)+HCl(g)中受到启发,提出的在农药和有机合成工业中可获得副产品盐酸的设想已成为现实.试指出从上述反应产物中分离得到盐酸的最佳方法是(g表示物质为气态,l表示物质为液态.HCl极易溶于水,得到盐酸;有机物一般难溶于水)( )
| A、蒸馏法 | B、水洗分液法 |
| C、升华法 | D、有机溶剂萃取法 |
硬铝是制造飞机和宇宙飞船的理想材料,下列哪一项不应该是硬铝的性能( )
| A、加工性差 | B、强度高 |
| C、抗腐蚀 | D、密度小 |
 X、Y、R、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表:
X、Y、R、Z、W是元素周期表前四周期中常见的元素,其相关信息如下表: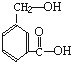 在某有机物A的分子中,具有醇羟基、羧基等官能团,其结构简式如图.
在某有机物A的分子中,具有醇羟基、羧基等官能团,其结构简式如图.