题目内容
3.某工厂从废含镍有机催化剂中回收镍的工艺流程如图所示(已知废催化剂中舍有Ni70.0%及一定量的Al、Fe、SiO2和有机物,镍及其化台物的化学性质与铁的类似,但Ni2-的性质较稳定).
已知:部分阳离子以氢氧化物的形式完全沉淀时的pH如下表所示,回答下列间题
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 9.2 |
(2)为提高酸浸速率,可采取的措施有(答两条)将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度.
(3)向A中加人 H2O2时反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O.试剂x可以是NaOH.
(4)用方程式表示出由沉淀.制取单质镍的方法Ni(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$NiO+H2O、2Al+2NiO$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Ni.
回收mkg上述废催化剂的过程中,若将溶液pH调整为6时消耗了a kgNi(OH)2,从洗涤到得到滤液B的过程中镍的损失率为3%,后几步操作过程中镍的损失率为5%,则最终得到单质镍的质量为(70%×97%m+$\frac{59}{93}$a)×95%kg(填计算式).
(5)利用化学镀(待镀件直接置于含有镀层金属的化合物的溶液中)可以在金属、塑料、陶瓷等物品表面镀上一层金属镍或铬等金属,某化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生的反应之一如下,请配平该反应.2Ni2++1H2PO2-+H2O=2Ni++1H2PO3-+2H+
与电镀相比,化学镀的最大优点是:不消耗电能,节约能源.
分析 用乙醇洗涤溶解并除去有机物杂质,“酸浸”时主要是溶解镍金属和铁、Al单质,只有SiO2不与硫酸反应,过滤得到滤渣a是SiO2;滤液A加入H2O2的目的是将Fe2+氧化为Fe3+,B溶液调节pH=6,使溶液中Fe3+、Al3+转化为氢氧化铁、氢氧化铝沉淀,通过过滤而除去,由表中数据,加入试剂X的目的是将镍转化为Ni(OH)2,故X是碱类物质;Ni(OH)2转化为单质镍的方法是先将其加热使其转化为NiO,然后用还原剂进行还原,如通过铝热反应.
(1)利用蒸馏的方法可将乙醇与其它有机物分离开;
(2)将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度均可提高酸浸速率;
(3)加入H2O2的目的是将Fe2+氧化为Fe3+.由表中数据及流程图知,加入试剂X的目的是将镍转化为Ni(OH)2,故X是碱类物质;
(4)Ni(OH)2转化为单质镍的方法是先将其加热使其转化为NiO,然后用还原剂进行还原,可以通过铝热反应进行;
计算m kg废催化剂中含镍的质量,计算滤液B中的镍元素质量,根据化学式计算Ni(OH)2中含镍的质量,将每一步的损失率都转化为Ni的损失率,根据Ni元素守恒计算最终得到的单质镍;
(5)首先依得失电子守恒配平氧化剂与还原剂、氧化产物与还原产物的计量数得:2Ni2++H2PO2-→2Ni++H2PO3-+,再依电荷守恒、质量守恒知还有水参与反应并有H+生成;
从能源消耗方面分析化学镀的优点.
解答 解:用乙醇洗涤溶解并除去有机物杂质,“酸浸”时主要是溶解镍金属和铁、Al单质,只有SiO2不与硫酸反应,过滤得到滤渣a是SiO2.滤液A加入H2O2的目的是将Fe2+氧化为Fe3+,B溶液调节pH=6,使溶液中Fe3+、Al3+转化为氢氧化铁、氢氧化铝沉淀,通过过滤而除去,由表中数据,加入试剂X的目的是将镍转化为Ni(OH)2,故X是碱类物质.Ni(OH)2转化为单质镍的方法是先将其加热使其转化为NiO,然后用还原剂进行还原,如通过铝热反应.
(1)用乙醇洗涤的目的是溶解并除去有机物杂质,利用蒸馏的方法可将乙醇与其它有机物分离开;因只有SiO2不与硫酸反应,故滤渣a是SiO2,
故答案为:SiO2;溶解、除去有机物;蒸馏;
(2)将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度均可提高酸浸速率,
故答案为:将废催化剂粉碎或适当地提高硫酸的浓度、浸泡时的温度;
(3)加入H2O2的目的是将Fe2+氧化为Fe3+,反应离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,由表中数据及流程图知,加入试剂X的目的是将镍转化为Ni(OH)2,故X是碱类物质,X可以为NaOH,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O;NaOH;
(4)Ni(OH)2转化为单质镍的方法是先将其加热使其转化为NiO,然后用还原剂进行还原,可以通过铝热反应进行,反应方程式为:Ni(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$NiO+H2O、2Al+2NiO$\frac{\underline{\;高温\;}}{\;}$Al2O3+3Ni;
m kg废催化剂中含镍的质量为70% m kg,在经过洗涤及酸浸转化到滤液B中的镍元素为70%×97% m kg,a kg Ni(OH)2中含镍为$\frac{59}{93}$a kg,根据Ni元素守恒,故最终得到的单质镍为(70%×97%m+$\frac{59}{93}$a)kg×95%,
故答案为:(70%×97%m+$\frac{59}{93}$a)×95%;
(5)首先依得失电子守恒配平氧化剂与还原剂、氧化产物与还原产物的计量数得:2Ni2++H2PO2-→2Ni++H2PO3-+,再依电荷守恒、质量守恒知还有水参与反应并有H+生成,配平后的离子方程式为:2Ni2++H2PO2-+H2O=2Ni++1H2PO3-+2H+;
与电镀相比,化学镀的最大优点是:不消耗电能,节约能源,
故答案为:2、1、H2O→2、1、2H+;不消耗电能,节约能源.
点评 本题以工艺流程为载体,考查了物质分离提纯、化学反应速率影响因素、沉淀转化、化学计算、氧化还原反应配平等,是高考常考题型,综合性较强,涉及知识面较广,侧重考查学生对知识的迁移应用,关键是对工艺流程理解分析,难度中等.

| A. | 2 mol/L NaOH的溶液 | B. | 2 mol/L Na2SO4的溶液 | ||
| C. | 2 mol/L MgSO4的溶液 | D. | FeCl3溶液 |
| 元素性质 编号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 0.89 | 0.82 | 0.77 | 0.99 | 0.75 | 1.17 | 1.43 |
| 最高或最低化合价 | +2 | +3 | +4 | +7 | +5 | +4 | +3 | |
| -2 | -4 | -1 | -3 | -4 |
(1)②的元素符号是Be;③的元素名称是硼;①在元素周期表中的位置是(周期,族)第二周期ⅥA族;⑧的离子结构示意图:

(2)比较⑤和⑥的最高价氧化物对应水化物的酸性大小:HClO4>HNO3;
(3)比较⑥和⑦的氢化物的稳定性:NH3>SiH4;⑥的氢化物电子式为
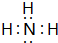 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”);(4)写出⑥的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4HNO3
(5)写出⑧的最高价氧化物对应水化物跟短周期中碱性最强的氢氧化物反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(6)④的氢化物与⑤的单质(体积比为1:2)在光照条件下反应,生成的有机产物有4种,其中常温下是气体的是CH3Cl,含有4个相同极性键的是CCl4.
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3 s内的平均速率v(NO2)=0.24 mol•L-1•s-1 | |
| B. | 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20% |
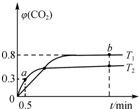 利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | T1<T2,△H>0 | |
| B. | T1温度下,该反应的平衡常数为1 024 | |
| C. | T2温度下,0~0.5 min内,CO的平均反应速率为0.3 mol•L-1•min-1 | |
| D. | T1温度下,若向装有足量I2固体的2 L恒容密闭容器中通入10 mol CO2,达到平衡时,φ(CO2)=0.8 |
| A. | 中子数为20的氯原子:${\;}_{17}^{20}Cl$ | B. | 四氯化碳的电子式: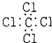 | ||
| C. | 铝原子的结构示意图: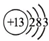 | D. | 二氧化碳的结构式:O-C-O |
| A. | 可以采用多次盐析或多次渗析的方法分离、提纯蛋白质 | |
| B. | 向淀粉溶液中加入稀H2SO4,水浴加热一段时间后,取出部分水解液滴加碘水,若溶液变蓝,证明淀粉未发生水解 | |
| C. | 将蔗糖和稀H2SO4加热水解后的液体取出少许,加入新制的Cu(OH)2并加热煮沸,无红色沉淀生成,证明蔗糖未发生水解生成葡萄糖 | |
| D. | 蛋白质溶液中加入丙酮可以使蛋白质从溶液中析出,再加水又能溶解 |
