题目内容
5.为探究Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:
定性分析:(1)如图甲所示可通过观察两支试管中产生气泡的快慢,定性比较得出结论.
(2)有同学提出试剂的选择不妥,应将FeCl3改为更为Fe2(SO4)3合理.
(3)H2O2在二氧化锰作用下发生的反应可分为两步,第一步的方程式为:2MnO2+H2O2=2HMnO3,第二步的化学方程式为:2HMnO3+H2O2=2MnO2+2H2O+O2↑,若第一步反应慢第二步反应快,则总反应速率由第一步(填“第一步”或“第二步”)决定.
定量分析:(4)如图乙所示,以实验时均生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是:产生40ml气体所需要的时间.
分析 定性分析:
(1)探究Fe3+和Cu2+对H2O2分解的催化效果,根据反应生成气体的快慢分析;
(2)氯化铁和硫酸铜溶液中阴离子不同,催化作用不能确定;
(3)二氧化锰是催化剂参与反应过程,最后又生成,根据反应物、生成物、反应条件写出反应方程式.
定量分析:
(4)该反应是通过反应速率分析的,所以根据v=$\frac{△V}{△t}$判断.
解答 解:定性分析:
(1)该反应中过氧化氢分解产生气体,所以可根据生成气泡的快慢判断,通过观察两支试管中产生气泡的快慢,定性比较得出结论,
故答案为:两支试管中产生气泡的快慢;
(2)氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用;硫酸钠和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,应将FeCl3改为更为Fe2(SO4)3 合理,
故答案为:Fe2(SO4)3;
(3)双氧水在二氧化锰作用下生成水和氧气,所以反应方程式为2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,H2O2在二氧化锰作用下发生的反应可分为两步,第一步的方程式为:2MnO2+H2O2=2HMnO3,第二步的化学方程式为:2HMnO3+H2O2=2MnO2+2H2O+O2↑,若第一步反应慢第二步反应快,则总反应速率由慢的一步决定,总反应速率由第一步决定,
故答案为:2HMnO3+H2O2=2MnO2+2H2O+O2↑;第一步;
定量分析:
(4)该反应是通过生成气体的反应速率分析判断的,所以根据v=$\frac{△V}{△t}$知,需要测量的数据是产生40ml气体所需要的时间,
故答案为:产生40ml气体所需要的时间.
点评 本题考查了催化剂的作用及化学反应速率的影响因素等知识点,题目难度中等,要会分析将FeCl3改为Fe2(SO4)3更为合理的理由.

| A. |  1,3,4-三甲苯 1,3,4-三甲苯 | |
| B. |  3-乙基-1-丁烯 3-乙基-1-丁烯 | |
| C. | 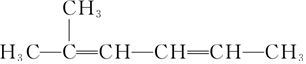 2-甲基-2,4-己二烯 2-甲基-2,4-己二烯 | |
| D. |  2,4,4-三甲基戊烷 2,4,4-三甲基戊烷 |
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝与稀盐酸反应 | ||
| C. | 炽热的炭与CO2反应 | D. | 酸碱中和反应 |
①位于第7周期
②非金属元素
③最外电子层有5个电子
④没有放射性
⑤属于氮族元素
⑥属于锕系元素.
| A. | ①③⑤ | B. | ②④⑥ | C. | ①③⑥ | D. | ③④⑤ |
| A. | 升高温度,该反应速率减慢 | |
| B. | 由该反应可知铁比铝活泼 | |
| C. | 反应物的总能量一定大于生成物的总能量 | |
| D. | 因该反应为放热反应,故不必加热就可发生 |
| A. | 原子半径A>B>D>C | B. | 原子序数d>c>b>a | ||
| C. | 离子半径C3->D->B+>A2+ | D. | 还原性D->C3- |
 25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图 (忽略溶液体积的变化、H2S的挥发).
25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图 (忽略溶液体积的变化、H2S的挥发).