题目内容
 印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费.通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3 溶液,作腐蚀液原料循环使用.
印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费.通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3 溶液,作腐蚀液原料循环使用.(1)步骤①中发生反应的离子方程式:
(2)步骤②需加入的试剂A是
(3)检验溶液中Fe3+存在的试剂是
(4)步骤③通入的气体B是
(5)为测定滤渣中铜的质量分数,取50g的滤渣与足量的试剂A反应,得到5.6L气体(标准状况下),则滤渣中铜的质量分数为
(6)若向硫酸亚铁溶液中滴加氢氧化钠溶液,观察到的现象是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:由流程可知,废腐蚀液含有大量CuCl2、FeCl2、FeCl3,加过量Fe,CuCl2、FeCl3均反应,铁粉过量,则滤液1为FeCl2,滤渣中含Fe、Cu,加过量试剂A为盐酸,过滤得到金属Cu,滤液2中含FeCl2、HCl,为不引人杂质,将铁的化合物全部转化为FeCl3溶液,则气体B为氯气,以此来解答.
解答:
解:(1)印刷电路的废腐蚀液中的CuCl2、FeCl3与铁粉反应生成Fe2+、Cu;CuCl2与铁粉反应的离子方程式为:Fe+Cu2+=Fe2++Cu;FeCl3与铁粉反应的离子方程式为:2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+、Fe+Cu2+=Fe2++Cu;
(2)滤渣中含有Fe和Cu,若要除去其中的Fe选用盐酸,然后过滤,故答案为:HCl;
(3)检验溶液中Fe3+存在的试剂是KSCN溶液,现象为溶液为血红色,故答案为:KSCN溶液;溶液为血红色;
(4)废腐蚀液加铁粉后,溶液为亚铁离子的溶液,通入氯气得到三氯化铁溶液,其反应的化学方程式为2FeCl2+Cl2=2FeCl3,故答案为:Cl2;2FeCl2+Cl2=2FeCl3;
(5)取50g的滤渣与足量的HCl反应,得到5.6L氢气,则n(H2)=
=0.25mol,已知发生的反应方程式为Fe+2HC1=FeCl2+H2↑,所以n(Fe)=0.25mol,m(Fe)=nM=0.25mol×56g/mol=14g,则m(Cu)=50-14=36g,所以滤渣中铜的质量分数为
×100%=72%,故答案为:72%;
(6)FeSO4溶液中滴加NaOH溶液,FeSO4和NaOH发生复分解反应生成白色沉淀Fe(OH)2,Fe(OH)2不稳定,易被氧气氧化生成红褐色沉淀Fe(OH)3,所以看到的现象是:先生成白色沉淀,白色沉淀立即转化为灰绿色,最终转化为红褐色,反应方程式分别为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:先生成白色沉淀,白色沉淀立即转化为灰绿色,最终转化为红褐色;FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(2)滤渣中含有Fe和Cu,若要除去其中的Fe选用盐酸,然后过滤,故答案为:HCl;
(3)检验溶液中Fe3+存在的试剂是KSCN溶液,现象为溶液为血红色,故答案为:KSCN溶液;溶液为血红色;
(4)废腐蚀液加铁粉后,溶液为亚铁离子的溶液,通入氯气得到三氯化铁溶液,其反应的化学方程式为2FeCl2+Cl2=2FeCl3,故答案为:Cl2;2FeCl2+Cl2=2FeCl3;
(5)取50g的滤渣与足量的HCl反应,得到5.6L氢气,则n(H2)=
| 5.6L |
| 22.4L/mol |
| 36g |
| 50g |
(6)FeSO4溶液中滴加NaOH溶液,FeSO4和NaOH发生复分解反应生成白色沉淀Fe(OH)2,Fe(OH)2不稳定,易被氧气氧化生成红褐色沉淀Fe(OH)3,所以看到的现象是:先生成白色沉淀,白色沉淀立即转化为灰绿色,最终转化为红褐色,反应方程式分别为:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:先生成白色沉淀,白色沉淀立即转化为灰绿色,最终转化为红褐色;FeSO4+2NaOH=Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评:本题考查混合物分离提纯的综合应用,为高频考点,把握流程中的反应及混合物分离方法为解答的关键,侧重分析与实验能力的综合考查,注意铁及其化合物的性质,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
用下列实验装置进行相应实验,不能达到实验目的是( )
A、 少量氨气的尾气吸收装置 |
B、 二氧化碳的喷泉实验 |
C、 制备和收集氨气 |
D、 收集NO气体 |
铝制用品在厨房里的用途很广泛,下列在使用铝制用品时正确的是( )
| A、用铝罐盛放食醋 |
| B、用铝锅烧开水 |
| C、铝制品用纯碱洗涤液洗涤 |
| D、用铝盒盛放漂白液 |
 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )
X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子数是内层电子数的3倍,下列说法中正确的是( )| A、四种元素的单质中,Z的熔沸点最高 |
| B、最高价氧化物对应水化物的酸性W比Z弱 |
| C、Y的气态氢化物的稳定性较Z的弱 |
| D、原子半径:W>Z>Y>X |
Na2HPO4溶液中存在下列电离平衡HPO42-?H++PO43-,欲使溶液中的c(HPO42-)、c(H+)、c(PO43-)均减少,可采取的方法是( )(已知HPO42-水解大于电离)
| A、加浓HCl |
| B、加熟石灰 |
| C、加烧碱晶体 |
| D、加NaCl溶液 |
下列气体在常温下有颜色的是( )
| A、NO2 |
| B、CO |
| C、HCl |
| D、N2 |
三氟化硼二甲醚配合物是一种有机催化剂.下列相关构成微粒的表示不正确的是( )
| A、二甲醚的结构简式:C2H6O | ||
B、中子数为5的硼原子:
| ||
C、氟原子结构示意图: | ||
D、三氟化硼的电子式: |
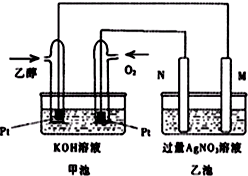 如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
如图是一个乙醇燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题: (R,R′可以是相同的烃基,也可能是不同的烃基)
(R,R′可以是相同的烃基,也可能是不同的烃基) 的过程如下(反应条件和部分产物没有列出):
的过程如下(反应条件和部分产物没有列出):