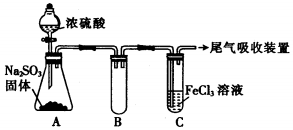
题目内容
11.下列根据实验现象作出的推断,正确的是( )| A. | 溶于水后能形成无色溶液的红棕色气体一定是Br2 | |
| B. | 能使润湿的淀粉碘化钾试纸变蓝的气体一定是Cl2 | |
| C. | 遇空气立即形成红棕色气体的一定是NO | |
| D. | 在潮湿空气中能形成白雾的气体一定是HCl |
分析 A.溶于水后能形成无色溶液的红棕色气体可能为二氧化氮、溴蒸气;
B.能使润湿的淀粉碘化钾试纸变蓝的气体,具有氧化性,如氯气、臭氧等;
C.NO为无色,遇到空气被氧化为红棕色的二氧化氮;
D.极易结合水蒸气形成小液滴的观察到白雾.
解答 解:A.溶于水后能形成无色溶液的红棕色气体可能为二氧化氮、溴蒸气,则不一定为Br2,故A错误;
B.能使润湿的淀粉碘化钾试纸变蓝的气体,具有氧化性,如氯气、臭氧等,则不一定为Cl2,故B错误;
C.NO为无色,遇到空气被氧化为红棕色的二氧化氮,则遇空气立即形成红棕色气体的一定是NO,故C正确;
D.极易结合水蒸气形成小液滴的观察到白雾,则在潮湿空气中能形成白雾的气体可能是HCl、硝酸等,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
 百年学典课时学练测系列答案
百年学典课时学练测系列答案
相关题目
2.以下转化不能通过一步反应实现的是( )
| A. | BaCO3→Na2CO3 | B. | SO2→Na2SO3 | C. | Fe→FeCl2 | D. | CaCO3→Ca(NO3)2 |
19.某工业废水中大量存在以下浓度的几种离子:0.4mol/LCl-、0.8mol/L SO42-、0.2mol/LAl3+、0.6mol/LH+、R离子,则R离子及其物质的量浓度可能为( )
| A. | 0.8 mol/LAg+ | B. | 0.4mol/L Ba2+ | C. | 0.4mol/L Mg2+ | D. | 0.2mol/L CO32- |
16.下列离子方程式书写正确的是( )
| A. | 钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 铝粉投入到 NaOH 溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| C. | 铁粉与稀硫酸溶液反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Cl2 与烧碱溶液跟反应:Cl2+2OH-═Cl-+ClO-+H2O |
3.用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 含有NA个原子的氢气在标准状况下的体积约为22.4 L | |
| B. | 25℃,1.01×105 Pa,64 g SO2中含有的原子数为3NA | |
| C. | 常温常压下,32gO2和32g O3所含氧原子数分别是2NA和3NA | |
| D. | Na2O2与CO2反应每生成1mol O2时所转移的电子数为4NA |