题目内容
实验室需要制备纯净的氯化钾.现有含少量KBr和K2SO4的氯化钾样品,按照下图所示的实验方案进行提纯.
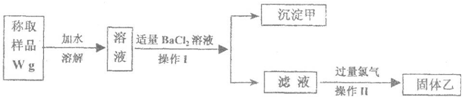
请回答下列问题:
(1)操作I的名称为 ,操作Ⅱ所需要的玻璃仪器有 .
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由 .
(3)若实验所得固体甲的质量为W1g,则样品中K2SO4的质量分数计算式为 .
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应该加入过量氯化钡溶液,请你按照他的思路,用上述实验流程图表示出他后面的实验过程,要注明所用试剂和所得产物的化学式以及相应操作的名称 .

请回答下列问题:
(1)操作I的名称为
(2)若用硝酸钡来代替氯化钡,是否可行?请说明理由
(3)若实验所得固体甲的质量为W1g,则样品中K2SO4的质量分数计算式为
(4)某同学对该实验方案提出质疑,他认为加适量氯化钡溶液不容易控制,应该加入过量氯化钡溶液,请你按照他的思路,用上述实验流程图表示出他后面的实验过程,要注明所用试剂和所得产物的化学式以及相应操作的名称
考点:制备实验方案的设计,物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:样品加水溶解后,加入适量的氯化钡溶液,得到的沉淀甲为BaSO4,根据BaSO4的质量可确定样品中K2SO4的质量分数;滤液中含有氯化钾和溴化钾,在氯气中通入过量氯气,经蒸发、浓缩、冷却结晶可得到氯化钾,如在实验中加入过量的氯化钡,则过滤后得到的滤液中含有氯化钾、溴化钾以及氯化钡,应加入过量的碳酸钾,过滤后在滤液中分别加热盐酸和氯气,然后蒸发结晶可得到氯化钾,以此解答.
解答:
解:(1)操作I用于分离固体和液体混合物,应为过滤操作,操作Ⅱ为蒸发,需要的玻璃仪器有玻璃棒和酒精灯,故答案为:过滤;玻璃棒、酒精灯;
(2)若用硝酸钡来代替氯化钡,则硝酸根在溶液中不能除掉,故答案为:否,会引入硝酸钾杂质;
(3)沉淀甲为BaSO4,n(BaSO4)=
=
mol,则n(K2SO4)=
mol,m(K2SO4)=
mol×174g/mol,
所以ω(K2SO4)=
×100%,
故答案为:
×100%;
(4)氯化钾、溴化钾,硫酸钾中硫酸钾能与氯化钡反应生成硫酸钡白色沉淀,过滤后滤液中含有氯化钾、溴化钾和过量的氯化钡,然后加入过量碳酸钾,会和氯化钡反应生成碳酸钡白色沉淀和氯化钾,过滤得到BaCO3沉淀,滤液中含有氯化钾、溴化钾和过量的碳酸钾,在此基础上加入过量盐酸反应生成氯化钾、水和二氧化碳,可以将碳酸根离子除掉,然后通入氯气,溴化钾会与氯气反应生成氯化钾和溴单质,经蒸发结晶可得到纯净的KCl,流程为 ,
,
故答案为: .
.
(2)若用硝酸钡来代替氯化钡,则硝酸根在溶液中不能除掉,故答案为:否,会引入硝酸钾杂质;
(3)沉淀甲为BaSO4,n(BaSO4)=
| W1g |
| 233g/mol |
| W1 |
| 233 |
| W1 |
| 233 |
| W1 |
| 233 |
所以ω(K2SO4)=
| 174W1 |
| 233W |
故答案为:
| 174W1 |
| 233W |
(4)氯化钾、溴化钾,硫酸钾中硫酸钾能与氯化钡反应生成硫酸钡白色沉淀,过滤后滤液中含有氯化钾、溴化钾和过量的氯化钡,然后加入过量碳酸钾,会和氯化钡反应生成碳酸钡白色沉淀和氯化钾,过滤得到BaCO3沉淀,滤液中含有氯化钾、溴化钾和过量的碳酸钾,在此基础上加入过量盐酸反应生成氯化钾、水和二氧化碳,可以将碳酸根离子除掉,然后通入氯气,溴化钾会与氯气反应生成氯化钾和溴单质,经蒸发结晶可得到纯净的KCl,流程为
 ,
,故答案为:
 .
.
点评:本题综合考查物质的制备和提纯等知识,侧重于学生的分析能力、实验能力和计算能力的考查,为高考常见题型,注意把握实验的操作原理和步骤,把握相关物质的性质,难度中等.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
下列反应不能通过一步反应实现的是( )
| A、Cu→CuSO4 |
| B、Fe→FeCl2 |
| C、Al2O3→Al(OH)3 |
| D、CO2→C |
能在强酸性溶液中大量共存的一组离子是( )
| A、K+、Cu2+、SO42-、NO3- |
| B、Na+、Ba2+、Br-、SO42- |
| C、NH4+、Fe3+、Cl-、SCN- |
| D、K+、Fe2+、Cl-、NO3- |
“善待地球--科学发展.”下列行为中不符合这一主题的是( )
| A、发展循环经济,构建资源节约型社会 |
| B、大量砍伐森林,以满足人们对木材的需求 |
| C、减少直至不使用对大气臭氧层起破坏作用的氟氯烃 |
| D、采用“绿色化学”工艺,建立环境友好型化工体系 |

