题目内容
19.磷酸铁(FePO4•2H2O,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁.(1)钢铁锈蚀是目前难以解决的现实问题,电化学腐蚀最为普遍.写出在潮湿空气中钢铁发生吸氧锈蚀时正极的电极反应式:O2+4e-+2H2O═4OH-.铁锈的主要成分是Fe2O3(填写化学式),将生锈的铁屑放入H2SO4溶液中充分溶解后,在溶液中并未检测出Fe3+,用离子方程式说明原因:Fe+2Fe3+=3Fe2+.
(2)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是加快Fe和稀硫酸的反应速率.
(3)向滤液中加入一定量H2O2氧化Fe2+.为确定加入H2O2的量,需先用K2Cr2O7标准溶液滴定滤液中的Fe2+,离子方程式如下:
Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、用蒸馏水洗和用标准液润洗2-3次,应选用酸式滴定管.
②若滴定xmL滤液中的Fe2+,消耗amol•L-1 K2Cr2O7标准溶液bmL,则滤液中c(Fe2+)=$\frac{6ab}{x}$ mol•L-1
③为使滤液中的Fe2+完全被H2O2氧化,下列实验条件控制正确的是A、B(填序号).
A.加入适当过量的H2O2溶液 B.缓慢滴加H2O2溶液并搅拌
C.加热,使反应在较高温度下进行 D.用氨水调节pH=7.
分析 本题以实验室制备磷酸铁为载体,探究铁在潮湿的空气里发生吸氧腐蚀得到氧化铁的原理、溶液里Fe3+和Fe2+的转化及检验、以及利用氧化还原反应原理进行滴定测定溶液里Fe2+的浓度,还考查了通过升温、搅拌等可以加快反应速率等理论,据此可作答;
(1)铁在潮湿的空气里很容易发生电化学腐蚀,主要是吸氧腐蚀,正极上氧气得电子被还原,铁锈的主要成份是氧化铁,用硫酸溶解生锈有铁屑时,氧化铁和硫酸反应生成硫酸铁,铁与硫酸铁反应生成硫酸亚铁,如果铁过量,溶液里应该没有
+3价铁;
(2)结合影响反应速率的影响因素可知温度越高,反应速率越快;
(3)①K2Cr2O7溶液具有强氧化性,应装在酸式滴定管中,注入前酸式滴定管要检漏、水洗,最后再用标准的K2Cr2O7溶液润湿;
②根据Fe2+和K2Cr2O7之间的关系式计算亚铁离子物质的量,再计算得到浓度;
③为使滤液中的Fe2+完全被H2O2氧化,加入的氧化剂要过量,且使反应物充分反应.
解答 解:(1)铁在潮湿的空气里发生吸氧腐蚀,正极电极反应式为O2+4e-+2H2O═4OH-,生成的铁锈主要成份是Fe2O3,将生锈的铁屑放入H2SO4溶液中充分溶解后,因过量的铁能将+3价的铁还原成+2价,因此反应后的溶液里不一定有Fe3+,发生反应的离子方程式为Fe+2Fe3+=3Fe2+,故答案为:O2+4e-+2H2O═4OH-;Fe2O3;Fe+2Fe3+=3Fe2+;
(2)温度越高,反应速率越快,所以反应加热的目的是加快铁与稀硫酸反应速率,故答案为:加快Fe和稀硫酸的反应速率;
(3)①向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、用蒸馏水洗,为防止滴定管附着的水稀释标准液,还需要用用标准液润洗2-3次,K2Cr2O7溶液具有强氧化性,能氧化橡胶管,需要盛放在酸式滴定管中,故答案为:用标准液润洗2-3次;酸式;
②若滴定v mL滤液中的Fe2+,消耗a mol•L-1 KMnO4标准溶液b mL,Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,
根据Fe2+和K2Cr2O7之间的关系式得c(Fe2+)=$\frac{amol/L×b×1{0}^{-3}L×6}{v×1{0}^{-3}L}$=$\frac{6ab}{x}$mol/L,故答案为:$\frac{6ab}{x}$;
③A、加入适当过量的H2O2溶液,导致铁离子能完全反应,故A正确;
B、缓慢滴加H2O2溶液并搅拌,反应物接触面积增大,能使铁离子完全反应,故B正确;
C、加热,使反应在较高温度下进行,虽然反应速率加快,但能促进亚铁离子水解而产生杂质,故C错误;
D、用氨水调节溶液pH=7,亚铁离子和氢氧根离子反应生成氢氧化亚铁杂质,故错误;
故答案为:A、B.
点评 本题以铁及其化合物为载体考查了物质的制备,涉及氧化还原反应、实验操作、反应速率的影响因素等知识点,根据物质之间的关系式、实验操作的规范性、影响反应速率的因素等知识点来分析解答,题目难度中等.

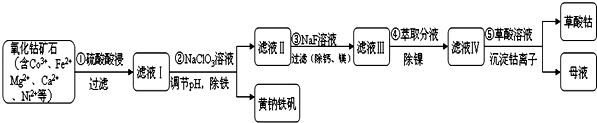
(1)步骤①中研究矿石粒度对钴浸出率的影响如表.从表中分析选择矿石粒度为-200目.
| 序号 | 矿石粒度/目 | 钴浸出率/% |
| 1 | -60 | 9.8 |
| 2 | -120 | 25.5 |
| 3 | -200 | 41.18 |
(3)Ⅰ.步骤②中NaClO3将Fe2+氧化成Fe3+的离子方程式并标出电子转移方向和数目
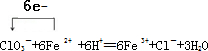 .
.Ⅱ.探究温度对步骤②中NaClO3将Fe2+氧化成Fe3+的影响,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,测定c(Fe2+)的变化,结果如图,请从图中分析最合适的温度下,在0s 至120s内的平均反应速率v(Fe2+)=0.25 mol•L-1•min-1.

(4)请写出步骤 ③中除去镁离子的离子反应方程式Mg2++2F-=MgF2↓.
(5)若要检验黄钠铁矾[Na2 Fe6(SO4)4(OH)12]中含有的金属元素,请简述实验方案:取黄钠铁矾用盐酸溶液溶解,分成两份,一份做火焰色反应,火焰为黄色证明有Na+存在;另一份向其中滴加KSCN溶液,溶液变成血红色,证明有Fe3+存在.
(6)从绿色化学角度分析,母液中可循环利用的物质为硫酸(填写名称).
 能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO(g)+2H2(g)?CH3OH(g)△H1
反应II:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是Ⅰ(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CH3OH)=0.8mol/L,则CO的转化率为80%,此时的温度为250℃(从上表中选择).
④恒温、恒容时,下列情况不能说明反应I已经达到化学平衡状态的是d.
a、容器各物质的浓度保持不变; b、容器内压强保持不变;
c、υ(CO)消耗═1/2υ(H2)生成 d、容器内的密度保持不变
(2)25℃、101kPa时,燃烧16g液体甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式:CH3OH(l)+$\frac{3}{2}$O2(g )═CO2(g )+2H2O(l)△H1=-726.52 kJ/mol.
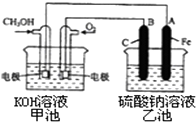
(3)某实验小组依据甲醇燃烧的反应原理,设计一个燃料电池电解Na2SO4溶液(图如下).请根据图示回答下列问题:
①通入甲醇蒸气的电极应为负极(填写“正”或“负”),该电极上发生的电极反应是b(填字母代号).
a.2CH3OH-12e-+3O2═2CO2+4H2O
b.CH3 OH-6e-+8OH-═CO32-+6H2O
c.O2+2H2O+4e-═4OH-
d.O2-4e-+4H+═2H2O
②写出电极A的名称阴极.写出B电极的电极反应式4OH--4e-═O2↑+2H2O.
③当碱性甲醇燃料电池消耗3.36L 氧气时(折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是0.45mol.
| A. | 物质的量 | B. | 密度 | C. | 质量 | D. | 含有的原子数 |
| A. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、NO3-、SO42- | |
| B. | 0.1 mol•L-1Na2S溶液:SO42-、K+、Cl-、Cu2+ | |
| C. | 0.1 mol•L-1AgNO3 溶液:H+、K+、SO42-、Br- | |
| D. | 0.1 mol•L-1NaAlO2 溶液:OH-、Na+、Cl-、SO42- |
| A. | 若Zn和MnO2都是足量的,则前一反应中盐酸全部被还原,后一反应中盐酸部分被氧化 | |
| B. | 两个都是氧化还原反应 | |
| C. | 盐酸都是被还原 | |
| D. | 等物质的量的Zn和MnO2分别与足量的浓盐酸反应,转移的电子数相等 |
 反应速率偏高
反应速率偏高