题目内容
A、B、C、D、E五种元素,它们的质子数依次递增,但都小于18.A元素原子核外只有1个电子.B元素原子和C元素原子最外层电子数之差为2.B元素原子L层上的电子数为K层电子数的2倍.B、C、D三种元素可以形成化学式为D2BC3的化合物,其焰色反应为黄色.0.5mol E元素的单质与足量的酸反应有9.03×1023个电子发生转移.在E和C的化合物中,E的质量占52.94%,又已知E的原子核中有14个中子.
(1)写出五种元素的名称:
A ,B ,C ,D ,E .
(2)画出D原子结构示意图、E阳离子结构示意图 、 .
(3)BC2的电子式为 ,BA4的结构式为 .
(4)五种元素中原子半径最小的是 ,金属性最强的是 .(填元素符号)
(1)写出五种元素的名称:
A
(2)画出D原子结构示意图、E阳离子结构示意图
(3)BC2的电子式为
(4)五种元素中原子半径最小的是
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A元素原子核外只有1个电子,则A为H元素;
B元素原子L层上的电子数为K层电子数的2倍,则B为C元素;
B元素原子和C元素原子最外层电子数之差为2,质子数依次递增,则C为O元素;
0.5 mol E元素的单质与足量的酸反应有9.03×1023个电子发生转移,则E为+3价,在E和C的化合物为E2O3,E的质量占52.94%,设E的原子序数为x,则:
×100%=52.94%,解得x=27,又已知E的原子核中有14个中子,则E的原子序数为13,所以E为Al元素;
D2BC3的化合物,其焰色反应为黄色,则D为Na,以此进行解答.
B元素原子L层上的电子数为K层电子数的2倍,则B为C元素;
B元素原子和C元素原子最外层电子数之差为2,质子数依次递增,则C为O元素;
0.5 mol E元素的单质与足量的酸反应有9.03×1023个电子发生转移,则E为+3价,在E和C的化合物为E2O3,E的质量占52.94%,设E的原子序数为x,则:
| 2x |
| 2x+16×3 |
D2BC3的化合物,其焰色反应为黄色,则D为Na,以此进行解答.
解答:
解:(1)A元素原子核外只有1个电子,则A为H元素;B元素原子L层上的电子数为K层电子数的2倍,则B为C元素;B元素原子和C元素原子最外层电子数之差为2,质子数依次递增,则C为O元素;0.5 mol E元素的单质与足量的酸反应有9.03×1023个电子发生转移,则E为+3价,在E和C的化合物为E2O3,E的质量占52.94%,设E的原子序数为x,则:
×100%=52.94%,解得x=27,又已知E的原子核中有14个中子,则E的原子序数为13,所以E为Al元素;D2BC3的化合物,其焰色反应为黄色,则D为Na,
根据分析可知:A为氢、B为碳、C为氧、D为钠、E为铝,故答案为:氢;碳;氧;钠;铝;
(2)D为Na元素,钠原子的核电荷数=核外电子总数=11,其原子结构示意图为: ;
;
E为Al,其阳离子为铝离子,铝离子的核电荷数为13,最外层含有8个电子,铝离子结构示意图为: ,
,
故答案为: ;
; ;
;
(3)BC2为CO2,二氧化碳中含有两个碳氧双键,碳原子和氧原子都达到8电子稳定结构,二氧化碳的电子式为: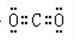 ;
;
BA4为CH4,甲烷中含有4个碳氢键,为正四面体结构,甲烷的结构式为: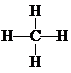 ,
,
故答案为: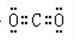 ;
;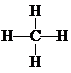 ;
;
(4)H、C、O、Na、Al五种元素中,H元素的电子层最少,所以H的原子半径最小;
金属元素为Na和Al,二者位于同一周期,Na的原子序数小于Al,则Na的金属性大于Al,
故答案为:H;Na.
| 2x |
| 2x+16×3 |
根据分析可知:A为氢、B为碳、C为氧、D为钠、E为铝,故答案为:氢;碳;氧;钠;铝;
(2)D为Na元素,钠原子的核电荷数=核外电子总数=11,其原子结构示意图为:
 ;
;E为Al,其阳离子为铝离子,铝离子的核电荷数为13,最外层含有8个电子,铝离子结构示意图为:
 ,
,故答案为:
 ;
; ;
;(3)BC2为CO2,二氧化碳中含有两个碳氧双键,碳原子和氧原子都达到8电子稳定结构,二氧化碳的电子式为:
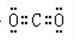 ;
;BA4为CH4,甲烷中含有4个碳氢键,为正四面体结构,甲烷的结构式为:
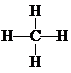 ,
,故答案为:
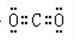 ;
;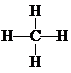 ;
;(4)H、C、O、Na、Al五种元素中,H元素的电子层最少,所以H的原子半径最小;
金属元素为Na和Al,二者位于同一周期,Na的原子序数小于Al,则Na的金属性大于Al,
故答案为:H;Na.
点评:本题考查位置、结构与性质关系的应用,题目难度中等,涉及了原子结构、电子式、结构式的书写,元素的推断是解答本题的关键,然后利用元素化合物知识来解答,注意掌握常见化学用语的书写方法.

练习册系列答案
相关题目
下列各组中的离子,能在溶液中大量共存的是( )
| A、H+、Na+、CO32- |
| B、H+、Ag+、NO3- |
| C、H+、OH-、SO42- |
| D、Cl-、Ba2+、SO42- |
下列叙述正确的是( )
| A、摩尔是指物质所含的粒子个数,它是物质的数量单位 |
| B、任何物质的摩尔质量等于它的相对原子质量或相对分子质量 |
| C、0.012kgC原子中的原子数为1mol |
| D、在标准状况下,CH4与CO2混合物22.4L,所含有的分子数为NA |
某元素的原子L电子层比M电子层多3个电子,下列说法中不正确的是( )
| A、该元素一定是短周期元素 |
| B、该元素容易和H2化合生成气态氢化物 |
| C、该元素是非金属元素 |
| D、该元素最高化合价为+5价 |
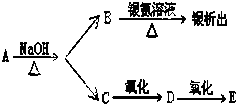 有机物A、B、C、D、E有如下衍生关系,又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C4H8O2.试写出A、B、C、D、E的结构简式.
有机物A、B、C、D、E有如下衍生关系,又知C和E在浓H2SO4作用下加热,得到一种具有果香味的液体,分子式为C4H8O2.试写出A、B、C、D、E的结构简式.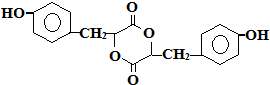 .
.