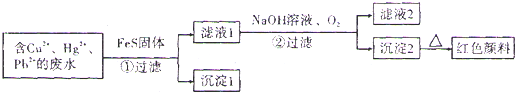
题目内容
下列离子方程式书写正确的是( )
| A、铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、氢氧化钡溶液加入稀硫酸中:OH-+H+═H2O |
| C、石灰石加入稀盐酸中:CaCO3+2H+=Ca2++CO2↑+H2O |
| D、铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag |
考点:离子方程式的书写
专题:离子反应专题
分析:A.铁与稀盐酸反应生成氯化亚铁和氢气,不会生成铁离子;
B.氢氧化钡与稀硫酸反应生成硫酸钡沉淀和水,漏掉了生成硫酸钡沉淀的反应;
C.石灰石的主要成分为碳酸钙,碳酸钙为难溶物,离子方程式中需要保留化学式;
D.根据电荷守恒判断,离子方程式两边正电荷不相等.
B.氢氧化钡与稀硫酸反应生成硫酸钡沉淀和水,漏掉了生成硫酸钡沉淀的反应;
C.石灰石的主要成分为碳酸钙,碳酸钙为难溶物,离子方程式中需要保留化学式;
D.根据电荷守恒判断,离子方程式两边正电荷不相等.
解答:
解:A.铁与稀盐酸反应生成氯化亚铁,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故A错误;
B.氢氧化钡溶液加入稀硫酸,反应生成硫酸钡和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C.石灰石加入稀盐酸中,反应生成氯化钙、二氧化碳气体和水,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故C正确;
D.铜与银离子反应生成银单质和铜离子,正确的离子方程式为:Cu+2Ag+═Cu2++2Ag,故D错误;
故选C.
B.氢氧化钡溶液加入稀硫酸,反应生成硫酸钡和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故B错误;
C.石灰石加入稀盐酸中,反应生成氯化钙、二氧化碳气体和水,反应的离子方程式为:CaCO3+2H+=Ca2++CO2↑+H2O,故C正确;
D.铜与银离子反应生成银单质和铜离子,正确的离子方程式为:Cu+2Ag+═Cu2++2Ag,故D错误;
故选C.
点评:本题考查了离子方程式的判断,为高考中的高频题,难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).

练习册系列答案
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案
相关题目
有机物HPE: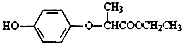 是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )
是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )
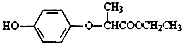 是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )
是一种合成农药所需的重要中间体.下列有关HPE的说法不正确的是( )| A、该有机物的分子式为C11H14O4 |
| B、该有机物具有7种不同化学环境的氢原子 |
| C、该有机物能与NaOH溶液反应,生成3种有机物 |
| D、1mol该有机物完全燃烧,将消耗12.5molO2 |
已知:①Na3N+3H2O═3NaOH+NH3↑,②NaH+H2O═NaOH+H2↑下列叙述正确的是( )
| A、离子半径:N3->Na+>H+ |
| B、反应①和②都是氧化还原反应 |
| C、反应①和②氧化剂都是H2O |
| D、Na3N和NaH与盐酸反应都只生成一种盐 |
用NA表示阿伏加德罗常数的值,下列叙述中不正确的是( )
| A、常温常压下,3.36L氯气与2.7g铝充分反应转移的电子数小于0.3NA |
| B、标准状况下,5.6L O2作氧化剂时转移电子数一定为NA |
| C、0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA |
| D、80g CuO和Cu2S的混合物含有铜原子数一定为NA |
下列各物质中物质的量最多的是(NA表示阿伏伽德罗常数)( )
| A、1 mol CO2 |
| B、标准状况下44.8 L H2 |
| C、3 NA 个水分子 |
| D、1 L 1 mol/L的硫酸钠溶液中所含的溶质 |