题目内容
5.工业上用铝土矿(主要成分为Al2O3,含Fe2O3等杂质)为原料冶炼铝的工艺流程如图,对下述流程中的判断正确的是: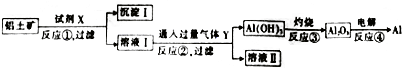
(1)沉淀I的主要成分为Fe2O3;溶液II的溶质为NaHCO3.
(2)试剂X为NaOH,Y为CO2;写出反应①的主要离子方程式:Al2O3+2OH-=2AlO2-+H2O.
(3)反应①〜④中属于氧化还原反应的是④(填序号)
分析 由工艺流程图可知,Al2O3溶于氢氧化钠溶液得到NaAlO2溶液,Fe2O3与氢氧化钠溶液不反应,则试剂X是NaOH,反应①过滤后所得溶液I为NaAlO2溶液,沉淀I为SiO2;Y为CO2,向NaAlO2溶液中通入过量CO2的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,过滤后分离后,溶液Ⅱ中含NaHCO3,电解熔融Al2O3属于氧化还原反应,以此解答该题.
解答 解:(1)由上述分析可知,沉淀I的主要成分为Fe2O3;溶液II的溶质为NaHCO3,故答案为:Fe2O3;NaHCO3;
(2)试剂X为NaOH,Y为CO2;反应①的主要离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:NaOH;CO2;Al2O3+2OH-=2AlO2-+H2O;
(3)反应①②为复分解反应,③为分解反应,且均无元素的化合价变化,只有④中Al、O元素的化合价变化,属于氧化还原反应的是④,故答案为:④.
点评 本题考查混合物分离提纯,为高频考点,把握发生的反应、混合物分离提纯为解答本题的关键,侧重分析与实验能力的考查,注意氧化铝的两性,题目难度不大.

练习册系列答案
相关题目
16.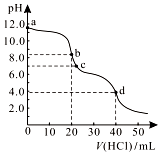 常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )
常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )
 常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )
常温下,用0.1000 mol/L的盐酸滴定20.00 mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示.下列有关叙述正确的是( )| A. | a点溶液呈碱性的原因用离子方程式表示为:CO32-+2H2O?H2CO3+2OH- | |
| B. | c点处的溶液中c(Na+)-c(Cl-)=c(HCO3-)+2c(CO32-) | |
| C. | 滴定过程中使用甲基橙作为指示剂比酚酞更准确 | |
| D. | d点处溶液中水电离出的c(H+)大于b点处 |
13.现有氯化钠、氯化铝、氯化铁、氯化镁四种溶液,只用一种试剂通过一步实验就能加从区别,这种试剂是
( )
( )
| A. | KSCN溶液 | B. | BaCl2溶液 | C. | NaOH溶液 | D. | HCl溶液 |
20.下列实验能达到对应实验目的是( )


| A. | 用装置甲完成实验室制取氯气 | |
| B. | 用装置乙除去二氧化碳中的少量氯化氢 | |
| C. | 用装置丙分离二氧化锰和氯化锰溶液 | |
| D. | 用装置丁蒸干碳酸氢钠溶液制NaHCO3固体 |
10.下列有关实验现象或结论的描述不正确的是( )
| A. | FeCl2溶液与K3[Fe(CN)6]混合后得到特征蓝色沉淀,利用此反应可检验Fe2+ | |
| B. | 向饱和食盐水中加入少量浓盐酸,看到溶液振荡,溶液变浑浊 | |
| C. | 某温度下,向AgCl饱和溶液中加入蒸馏水,AgCl的溶解度、Ksp均增大 | |
| D. | 处理含有Hg2+离子的废水可加入硫化钠,使Hg2+离子转化为HgS沉淀 |
14.下列有关物质的性质与用途说法不正确的是( )
| A. | FeCl3易溶于水,可用作净水剂 | |
| B. | 硅是半导体材料,纯净的硅是光纤制品的基本原料 | |
| C. | 浓硫酸能干燥氯气,说明浓硫酸具有吸水性 | |
| D. | 氨易液化,液氨气化吸收大量的热,所以液氨常用作制冷剂 |
8.金矿中的单质金,可用电解法在空气中用NaCN溶液提取,试判断下列各项中是阳极反应的为( )
| A. | Au-e-═Au+ | B. | O2+2H2O+4e-═4OH- | ||
| C. | Au-e-+2CN-═Au(CN)2- | D. | 2H2O+2e-═2OH-+H2 |