题目内容
4. 苏教版《化学1》“活动与探究”:配制100mL 0.100mol•L-1 Na2CO3溶液.
苏教版《化学1》“活动与探究”:配制100mL 0.100mol•L-1 Na2CO3溶液.(1)该实验需要用到的玻璃仪器主要有烧杯、玻璃棒、胶头滴管和100mL容量瓶.
(2)教材中有“称量:用天平准确称取碳酸钠固体①”.其中对①的注解:为保证实验精度,在称量固体时,应使用分析天平或者电子天平
(填仪器名称)称量Na2CO3固体.若条件限制,可用托盘天平代替进行练习.若用Na2CO3•10H2O晶体配制该溶液,需要2.86g晶体.
(3)如图1是实验过程的一幅图片.实验操作者右手手持的仪器(放大的图2)名称为洗瓶.
(4)定容时仰视刻度线会使所配制的Na2CO3溶液的浓度偏小.(填“偏大”、“偏小”或“无影响”)
分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择需要仪器;
(2)分析天平、电子天平精确度比托盘天平更高;依据m=CVM计算需要溶质Na2CO3•10H2O的质量;
(3)依据仪器形状说出其名称;
(4)定容时仰视刻度线会,导致溶液体积偏大,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,所以还缺少的玻璃仪器:100mL容量瓶;
故答案为:100mL容量瓶;
(2)为保证实验精度,在称量固体时,应使用分析天平或者电子天平;
配制100mL 0.100mol•L-1 Na2CO3溶液,需要溶质Na2CO3•10H2O的质量m=0.1L×0.100mol/L×286g/mol=2.86g;
故答案为:分析天平或者电子天平;2.86;
(3)依据图中仪器形状可知:图中仪器名称为:洗瓶;
故答案为:洗瓶;
(4)定容时仰视刻度线会,导致溶液体积偏大,依据C=$\frac{n}{V}$可知,溶液浓度偏小;
故答案为:偏小.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
14.已知H2CO3的酸性比HClO的酸性强,对反应:Cl2+H2O?HCl+HClO达到平衡后,要使HClO浓度增加可加入( )
| A. | NaOH | B. | HCl | C. | CaCO3(固体) | D. | H2O |
10.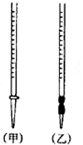 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:
(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶、胶头滴管.
(2)滴定:
①盛装0.1000mol•L-1的盐酸标准液应该使用甲(选填“甲”或“乙”).
②将一定体积的待测溶液装在锥形瓶内,若采用甲基橙做指示剂,当观察到由橙色变为黄色,且半分钟内不变色时,滴定达到终点.
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶后未烘干,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低.
(4)有关数据记录如下:
根据以上数据计算,烧碱样品的纯度是80.8%.
 用中和滴定法测定某烧碱样品的纯度.有以下步骤:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:(1)配制待测液:用已称好的5.0g含有少量杂质(杂质不与盐酸反应)的固体烧碱样品配制1000mL溶液.除烧杯和玻璃棒外,还需要用到的主要仪器有1000mL容量瓶、胶头滴管.
(2)滴定:
①盛装0.1000mol•L-1的盐酸标准液应该使用甲(选填“甲”或“乙”).
②将一定体积的待测溶液装在锥形瓶内,若采用甲基橙做指示剂,当观察到由橙色变为黄色,且半分钟内不变色时,滴定达到终点.
(3)误差讨论:(选填“偏高”、“偏低”或“无影响”)
①用蒸馏水冲洗锥形瓶后未烘干,测定结果无影响;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外,测定结果偏高;
③读数时,滴定前仰视,滴定后俯视,测定结果偏低.
(4)有关数据记录如下:
| 测定序号 | 待测溶液的体积(mL) | 所耗盐酸标准液的体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.20 | 21.32 |
| 3 | 20.00 | 0.40 | 21.20 |
11.过氧化钠(化学式为Na2O2)可用在呼吸面具中作为氧气来源.Na2O2能跟CO2反应生成O2和另一种固体化合物(用X表示);它也能跟H2O反应生成O2,化学方程式为:2Na2O2+2H2O═4NaOH+O2↑.以下是某兴趣小组进行的探究活动.
(1)利用如下图所示实验装置制取氧气,请回答有关问题.

①实验室制取CO2的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
②表明CO2未被Na2O2完全吸收的实验现象为澄清石灰水变浑浊.
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的氧气密度比空气的大,氧气有助燃性性质.
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进在A、B装置之间增加气体干燥装置
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验.
①有同学猜想X可能是酸、碱或盐中的一种.通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是Na2O2和CO2都不含氢元素,根据质量守恒定律,二者反应后不可能生成含氢元素的酸或碱.
②同学们通过讨论和实验证明了X是Na2CO3.以下是他们设计的有关Na2CO3性质的探究实验,将下表填写完整.
(3)7.8g过氧化钠与足量的水反应,生成氧气的质量是多少?若反应后得到了40g氢氧化钠溶液,请计算氢氧化钠溶液中溶质的质量分数..
(1)利用如下图所示实验装置制取氧气,请回答有关问题.

①实验室制取CO2的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
②表明CO2未被Na2O2完全吸收的实验现象为澄清石灰水变浑浊.
③O2可采用D装置收集,并用带火星的木条检验,这是利用了O2的氧气密度比空气的大,氧气有助燃性性质.
④若A装置产生的CO2中混有水蒸气,要检验干燥的CO2能否与Na2O2反应生成O2,以上实验装置应如何改进在A、B装置之间增加气体干燥装置
(2)为探究X是哪种物质及其有关性质,同学们进行了如下分析和实验.
①有同学猜想X可能是酸、碱或盐中的一种.通过对物质组成的分析,大家一致认为X肯定不是酸和碱,理由是Na2O2和CO2都不含氢元素,根据质量守恒定律,二者反应后不可能生成含氢元素的酸或碱.
②同学们通过讨论和实验证明了X是Na2CO3.以下是他们设计的有关Na2CO3性质的探究实验,将下表填写完整.
| 实验操作 | 现 象 | 有关的化学方程式 |
| 实验一:取少量固体样品,滴加稀盐酸,然后将产生的气体通入澄清石灰水 | 有气泡产生 澄清石灰水变浑浊 | Na2CO3+2HCl=2NaCl+H2O+CO2↑ CO2+Ca(OH)2=CaCO3↓+H2O |
| 实验二:取少量固体样品, 加水配成溶液,滴加适量的氯化钙或 氯化钡等 溶液 | 有白色沉淀产生 | Na2CO3+CaCl2=CaCO3↓+2NaCl或 Na2CO3+BaCl2=BaCO3↓+2NaCl等 |