题目内容
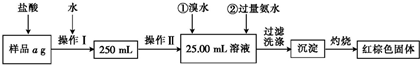
美国《科学》杂志评选的2001年十大科技进展之一是当年科学家发现了一种在接近40K的温度下成为超导材料的硼镁化合物.这种硼镁超导物质的晶体结构单元如图所示:
(1)试写出这种超导材料的化学式 ;
(2)该晶体的类型为 晶体.
(3)分别叙述该晶体中含有的化学键类型 .
(1)试写出这种超导材料的化学式
(2)该晶体的类型为

(3)分别叙述该晶体中含有的化学键类型
考点:晶胞的计算
专题:化学键与晶体结构
分析:(1)该晶胞中Mg原子个数=
×2+12×
=3,B原子个数=6,其化学式为两种元素原子个数最简比,据此确定化学式;
(2)根据晶体的构成微粒确定晶体类型;
(3)该晶体中,根据图片知,金属原子之间易形成金属键、金属原子和非金属原子之间易形成离子键,非金属原子之间易形成共价键.
| 1 |
| 2 |
| 1 |
| 6 |
(2)根据晶体的构成微粒确定晶体类型;
(3)该晶体中,根据图片知,金属原子之间易形成金属键、金属原子和非金属原子之间易形成离子键,非金属原子之间易形成共价键.
解答:
解:(1)该晶胞中Mg原子个数=
×2+12×
=3,B原子个数=6,其化学式为两种元素原子个数最简比,则Mg、B原子个数之比=3:6=1:2,其化学式为MgB2,故答案为:MgB2;
(2)该晶体中,根据图片知,Mg原子之间形成金属键、Mg和B原子之间存在离子键,所以属于混合型晶体,故答案为:混合型;
(3)该晶体中,根据图片知,Mg原子之间形成金属键、Mg和B原子之间存在离子键,且每个B原子和另外三个B原子形成共价键,B原子采用sp2杂化,
故答案为:Mg原子之间为金属键,Mg和B原子之间为离子键,B原子之间形成sp2杂化的共价键.
| 1 |
| 2 |
| 1 |
| 6 |
(2)该晶体中,根据图片知,Mg原子之间形成金属键、Mg和B原子之间存在离子键,所以属于混合型晶体,故答案为:混合型;
(3)该晶体中,根据图片知,Mg原子之间形成金属键、Mg和B原子之间存在离子键,且每个B原子和另外三个B原子形成共价键,B原子采用sp2杂化,
故答案为:Mg原子之间为金属键,Mg和B原子之间为离子键,B原子之间形成sp2杂化的共价键.
点评:本题考查晶胞计算,侧重考查学生分析、计算、空间想象能力,利用均摊法确定化学式,明确顶点上原子被几个晶胞共用是解本题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
关于反应H-+NH3═NH2-+H2的说法中,正确的是( )
| A、H-为氧化剂 |
| B、NH3为还原剂 |
| C、H2既是氧化产物又是还原产物 |
| D、属于非氧化还原反应 |
设NA为阿伏加德罗常数的值,下列叙述不正确的( )
| A、10g质量分数为46%的乙醇溶液中,氢原子的总数为1.2NA |
| B、5.6 g铁与足量硫加热充分反应转移电子数为 0.2NA |
| C、50 mL 12 mol?L-1 浓盐酸与足量二氧化锰加热反应,转移电子数为0.3 NA |
| D、标准状况下,含有1mol硫原子的SO2与SO3的混合物,其体积小于22.4L |
下列说法中正确的是( )
| A、p区元素全部都是主族元素 |
| B、稀有气体的原子的电子排布最外层都是以p6结束 |
| C、主族元素的原子核外电子最后填入的能级是s能级或p能级 |
| D、核外电子排布相同的微粒,一定具有相同的化学性质 |
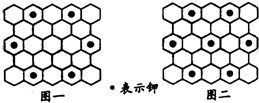 北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的石墨夹层离子化合物.将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等等.在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回.下列分析中正确的是( )
北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的石墨夹层离子化合物.将石墨置于熔融的钾或气态的钾中,石墨吸收钾而形成称为钾石墨的物质,其组成可以是C8K、C12K、C24K、C36K、C48K、C60K等等.在钾石墨中,钾原子把价电子交给石墨层,但在遇到与金属钾易反应的其他物质时还会收回.下列分析中正确的是( )| A、题干中所举出的6种钾石墨,属于同素异形体 | ||
| B、若某钾石墨的原于分布如图一所示,则它所表示的是C24K | ||
| C、若某钾石墨的原子分布如图二所示,则它所表示的是C12K | ||
D、另有一种灰色的钾石墨C32K,其中K的分布也类似图中的中心六边形,则最近两个K原子之间的距离为石墨键长的4
|
有一瓶Na2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加足量稀硝酸,充分振荡后,仍有白色沉淀,对此实验下述结论正确的是( )
| A、Na2SO3已部分被氧化 |
| B、加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 |
| C、加硝酸后的不溶沉淀一定是BaSO4和BaSO3 |
| D、此实验不能确定Na2SO3是否部分被氧化 |