题目内容
15.20mL Al2(SO4)3溶液加水稀释至100mL,稀释后的溶液中SO42-的物质的量浓度为0.3mol?L-1.则稀释前Al2(SO4)3的物质的量浓度为0.5mo1•L-1.分析 稀释过程中溶质的物质的量不变,据此计算出稀释前了硫酸根离子的浓度,然后结合硫酸铝的化学式计算出稀释前硫酸铝的物质的量浓度.
解答 解:20mL Al2(SO4)3溶液加水稀释至100mL,稀释后的溶液中SO42-的物质的量浓度为0.3mol?L-1,稀释过程中硫酸根离子的浓度不变,则稀释前SO42-的物质的量浓度为:c(SO42-)=$\frac{0.3mol/L×0.1L}{0.02L}$=1.5mol/L,
根据硫酸铝的化学式Al2(SO4)3可知,稀释前硫酸铝的物质的量浓度为:c[Al2(SO4)3]=$\frac{1}{3}$c(SO42-)=1.5mol/L×$\frac{1}{3}$=0.5mol/L,
故答案为:0.5 mo1•L-1.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,注意掌握稀释定律在物质的量浓度的计算中的应用方法,试题培养了学生的化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列有机物没有同分异构体的是( )
| A. | C4H10 | B. | CH3Cl | C. | CH2Cl2 | D. | C5H12 |
3.下列反应的离子方程式书写正确的是( )
| A. | 硫酸铜溶液与氢氧化钡溶液混合:Ba2++SO42-═BaSO4↓ | |
| B. | 大理石投入稀硝酸中:CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 氨水与硫酸铝溶液混合:Al3++4NH3?H2O═AlO2-+4NH4++2H2O | |
| D. | 氯水通入水中:Cl2+H2O═Cl-+ClO-+2H+ |
20.甲、乙、丙、丁均为中学化学中常见的单质或化合物,它们之间的转化关系如下图所示(部分产物已略去),如表各组物质中不能按图示关系转化的是( )
| 选项 | 物质转化关系 | 甲 | 乙 | 丙 | 丁 |
| A | 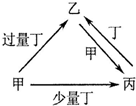 | NaOH | NaHCO3 | Na2CO3 | CO2 |
| B | C | CO | CO2 | O2 | |
| C | Fe | Fe(NO3)3 | Fe(NO3)2 | HNO3 | |
| D | AlCl3 | NaAlO2 | Al(OH)3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
7.常温下,0.1mol/L的下列溶液中,水的电离程度大小排列顺序正确的是( )
①AlCl3
②KNO3
③NaOH
④NH3•H2O.
①AlCl3
②KNO3
③NaOH
④NH3•H2O.
| A. | ①>②>③>④ | B. | ①>②>④>③ | C. | ③>④>②>① | D. | ①=②=③=④ |
4.二氧化氯是国际公认的高效安全杀菌消毒剂,工业制备ClO2的反应原理如下:2NaClO3+4HCl═2ClO2↑+Cl2↑+2H2O+2NaCl,下列关于该反应的说法正确的是( )
| A. | 浓盐酸在反应中仅体现还原性 | |
| B. | 被氧化和被还原的物质的物质的量之比为1:1 | |
| C. | 每生成0.1molClO2转移0.2mol电子 | |
| D. | 氧化性:NaClO3<Cl2 |



