题目内容
15.下列说法正确的是( )| A. | 含H+的溶液显酸性 | |
| B. | 加热蒸馏水,Kw变大,pH变小 | |
| C. | 常温下,0.01mol•L-1的Ba(OH)2溶液pH为12 | |
| D. | 醋酸溶液加水稀释,所有离子的浓度都减小 |
分析 A.任何电解质溶液中都存在H+、OH-;
B.水的电离是吸热反应,升高温度促进电离;
C.氢氧根离子浓度为Ba(OH)2的2倍;
D.醋酸加水稀释氢离子浓度减小,Kw不变.
解答 解:A.任何电解质溶液中都存在H+、OH-,根据c(H+)、c(OH-)对大小确定溶液酸碱性,故A错误;
B.水的电离是吸热反应,升高温度平衡向吸热反应方向移动,所以促进电离Kw变大,氢离子浓度增大,pH变小,故B正确;
C.常温下,0.01mol•L-1的Ba(OH)2溶液中氢氧根离子浓度为0.02mol•L-1,则溶液的pH大于12,故C错误;
D.醋酸加水稀释氢离子浓度减小,Kw不变,所以氢氧根离子的浓度增大,故D错误;
故选B.
点评 本题以离子积常数为载体,考查水的电离、离子积常数只与温度有关、pH的计算等,注意:化学平衡常数、电离平衡常数、盐类水解平衡常数、溶度积常数等都只与温度有关,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案
相关题目
4.下列实验操作能达到实验目的是( )
| A. | 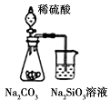 此装置可证明非金属性强弱:S>C>Si | |
| B. | 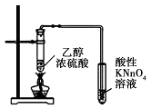 此装置可用于检验有乙烯生成 | |
| C. | 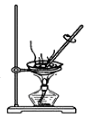 此装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体 | |
| D. | 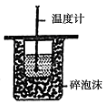 此装置可用来测定中和热 |
6.一定温度下,w1 g下列物质在足量O2中充分燃烧后,产物与足量Na2O2充分反应,增重w2 g,且w1=w2,则符合此条件的物质是( )
①H2;②CO;③H2和CO的混合气体;④HCOOCH3;⑤CH3CHO;⑥C6H12O6.
①H2;②CO;③H2和CO的混合气体;④HCOOCH3;⑤CH3CHO;⑥C6H12O6.
| A. | ①②③⑤⑥ | B. | ②③④⑤ | C. | ①②③④⑥ | D. | ①②③④⑤ |
20. 按如图装置进行实验,下列推断正确的是( )
按如图装置进行实验,下列推断正确的是( )
 按如图装置进行实验,下列推断正确的是( )
按如图装置进行实验,下列推断正确的是( )| 选项 | I中试剂 | II中试剂及现象 | 推断 |
| A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
| B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
| C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
| D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
| A. | A | B. | B | C. | C | D. | D |
7.分类法是化学学习中的一种重要方法,下列分类图正确的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
4.下列用途主要是体现铝的物理性质的是( )
①家用铝锅 ②盛浓硝酸的容器 ③制导线 ④焊接钢轨 ⑤包装铝箔 ⑥炼钢的脱氧剂⑦做防锈油漆 ⑧做合金用作飞机制造业材料 ⑨工业做热交换器.
①家用铝锅 ②盛浓硝酸的容器 ③制导线 ④焊接钢轨 ⑤包装铝箔 ⑥炼钢的脱氧剂⑦做防锈油漆 ⑧做合金用作飞机制造业材料 ⑨工业做热交换器.
| A. | ①②③④ | B. | ③④⑥⑦⑧⑨ | C. | ①③⑤⑦⑧⑨ | D. | ①③②④⑥⑧ |
5.为了使纯锌和0.05mol•L-1稀硫酸20mL反应速率加快,可以采取的措施是( )
| A. | 加入2mL0.1mol•L-1盐酸 | B. | 加入2mL0.1mol•L-1氢氧化钡溶液 | ||
| C. | 加入2mL0.1mol•L-1硫酸铜溶液 | D. | 加入2mL0.1mol•L-1氨水 |