题目内容
如图为长式周期表示意图,请根据A~G元素所在位置回答下列问题.
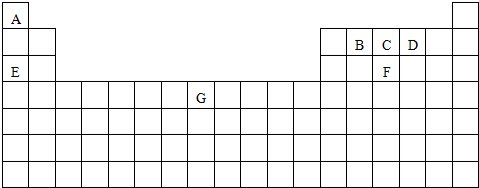
注:答题时需将代号A~G替换为相应的元素符号
(1)元素A与C可形成两种分子C2A4与CA3,写出C2A4的结构式 .
(2)元素E与D能形成两种化合物E2D2与E2D,写出E2D的电子式 .
(3)元素A~G中,属于过渡元素的是 .
(4)元素B、F的非金属性强弱关系为 ,设计实验验证此结论 .

注:答题时需将代号A~G替换为相应的元素符号
(1)元素A与C可形成两种分子C2A4与CA3,写出C2A4的结构式
(2)元素E与D能形成两种化合物E2D2与E2D,写出E2D的电子式
(3)元素A~G中,属于过渡元素的是
(4)元素B、F的非金属性强弱关系为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,A、B、C、D、E、F、G分别为H、C、N、O、Na、P、Fe元素,
(1)元素H与N可形成两种分子N2H4与NH3,N2H4分子相当于氨气分子中的一个H原子被氨基取代,据此书写N2H4的结构式;
(2)元素Na与O能形成两种化合物Na2O2与Na2O,Na2O为离子化合物,氧化钠中钠离子和氧离子之间存在离子键;
(3)副族元素和第VIII族元素属于过渡元素;
(4)P元素非金属性大于C,元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸.
(1)元素H与N可形成两种分子N2H4与NH3,N2H4分子相当于氨气分子中的一个H原子被氨基取代,据此书写N2H4的结构式;
(2)元素Na与O能形成两种化合物Na2O2与Na2O,Na2O为离子化合物,氧化钠中钠离子和氧离子之间存在离子键;
(3)副族元素和第VIII族元素属于过渡元素;
(4)P元素非金属性大于C,元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸.
解答:
解:根据元素在周期表中的位置知,A、B、C、D、E、F、G分别为H、C、N、O、Na、P、Fe元素,
(1)元素H与N可形成两种分子N2H4与NH3,N2H4分子相当于氨气分子中的一个H原子被氨基取代,所以N2H4的结构式为 ,
,
故答案为: ;
;
(2)元素Na与O能形成两种化合物Na2O2与Na2O,Na2O为离子化合物,氧化钠中钠离子和氧离子之间存在离子键,其电子式为 ,
,
故答案为: ;
;
(3)副族元素和第VIII族元素属于过渡元素,铁属于第VIII族元素,故答案为:Fe;
(4)P元素非金属性大于C,元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,将磷酸滴入碳酸氢钠溶液中,若有气泡产生可证明磷酸酸性强于碳酸,从而证明非金属性P>C,故答案为:P>C;将磷酸滴入碳酸氢钠溶液中,若有气泡产生可证明磷酸酸性强于碳酸,从而证明非金属性P>C.
(1)元素H与N可形成两种分子N2H4与NH3,N2H4分子相当于氨气分子中的一个H原子被氨基取代,所以N2H4的结构式为
 ,
,故答案为:
 ;
;(2)元素Na与O能形成两种化合物Na2O2与Na2O,Na2O为离子化合物,氧化钠中钠离子和氧离子之间存在离子键,其电子式为
 ,
,故答案为:
 ;
;(3)副族元素和第VIII族元素属于过渡元素,铁属于第VIII族元素,故答案为:Fe;
(4)P元素非金属性大于C,元素的非金属性越强,其最高价氧化物的水化物酸性越强,强酸能和弱酸盐反应生成弱酸,将磷酸滴入碳酸氢钠溶液中,若有气泡产生可证明磷酸酸性强于碳酸,从而证明非金属性P>C,故答案为:P>C;将磷酸滴入碳酸氢钠溶液中,若有气泡产生可证明磷酸酸性强于碳酸,从而证明非金属性P>C.
点评:本题考查元素周期表和元素周期律综合应用,明确物质结构、原子周期表结构、元素周期律知识即可解答,注意肼的结构式和乙烯不同,知道非金属性强弱判断方法,题目难度不大.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目
下列各组离子一定能大量共存的是( )
| A、在无色溶液中:K+、SO42-、Cu2+、NO3- |
| B、在强碱溶液中:Na+、K+、CO32-、NO3- |
| C、常温下,在pH=2的溶液中:K+、Na+、SO42-、Cl- |
| D、在c(H+)=0.1mol?L-1的溶液中:K+、I-、Cl-、NO3- |

 :
: :
: :
: :
:
