题目内容
10.X、Y是短周期元素,二者能形成化合物X2Y3.若已知X的原子序数为n,则Y的原子叙述不可能是( )| A. | n+11 | B. | n-5 | C. | n+3 | D. | n+4 |
分析 根据化合物X2Y3,则X元素的化合价为+3价,Y元素的化合价为-2价,则X可能为B或Al元素,Y可能为O或S元素,还存在特殊情况为X为N元素,Y为O元素形成的化合物,以此解答该题.
解答 解:A.若化合物X2Y3为B2S3,B的核电荷数为5,S的为16,已知X的核电荷数为n,则Y的核电荷数为n+11,故A正确;
B.若化合物X2Y3为Al2O3,Al的核电荷数为13,O的为8,已知X的核电荷数为n,则Y的核电荷数为n-5,故D正确;
C.若化合物X2Y3为Al2S3,Al的核电荷数为13,S的为16,已知X的核电荷数为n,则Y的核电荷数为n+3,故C正确;
D.根据价序原则,化合价为奇数的,核电荷数为奇数,化合价为偶数的,核电荷数为偶数,则X、Y的核电荷数之差不可能为偶数4,因奇数和偶数的差与和还是奇数,故D错误.
故选D.
点评 本题考查学生利用化合价与化学式及核电荷数的关系,为高频考点,侧重于学生的分析能力的考查,学生应熟悉常见的化合物中的元素的化合价及元素的核电荷数,能利用举例的方法或价序原则来分析解答.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
12.下列变化中属于化学变化的是( )
| A. | 由于冰得到二氧化碳气体 | |
| B. | 胆矾加热失去结晶水 | |
| C. | 烧瓶中盛有二氧化氮气体,加入活性炭后,红棕色逐渐消失 | |
| D. | 铜导电. |
9.用向上排空气法在烧瓶中收集氯化氢气体,一段时间后烧瓶中气体的相对分子质量是34.6,现将烧瓶置于水中,最后进入烧瓶的溶液的体积约占烧瓶体积的( )
| A. | 0 | B. | $\frac{1}{4}$ | C. | $\frac{1}{2}$ | D. | $\frac{3}{4}$ |
5. 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
部分阳离子以氢氧化物形式沉淀时的pH如表:
(1)“碱浸”过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑、Al2O3+2OH-═2AlO2-+3H2O
操作a中需要的玻璃仪器烧杯、漏斗、玻璃棒
(2)“酸浸”时所加入的酸是H2SO4 (填化学式).
(3)加入H2O2时发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2≤PH<7.1.
 某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).
某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO4•7H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%).部分阳离子以氢氧化物形式沉淀时的pH如表:
| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
操作a中需要的玻璃仪器烧杯、漏斗、玻璃棒
(2)“酸浸”时所加入的酸是H2SO4 (填化学式).
(3)加入H2O2时发生反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O
(4)操作b为调节溶液的pH,你认为pH的调控范围是3.2≤PH<7.1.
15.将9.6gCu投入到一定浓度的HNO3溶液中,恰好完全反应,产生NO2 和NO的混合气体共5.6L(标况下).则原溶液中HNO3 的物质的量为( )
| A. | 0.18mol | B. | 0.25mol | C. | 0.36mol | D. | 0.55mol |
2.把7.2g铁粉投入40ml某浓度的硝酸中,充分反应后剩余固体1.6g,产生NO2和NO的混合气体0.08mol.若不考虑N2O4的存在,则该硝酸的物质的量浓度为( )
| A. | 3.5mol•L-1 | B. | 7.0mol•L-1 | C. | 4.5mol•L-1 | D. | 9.0mol•L-1 |
19.下列粒子的核外电子排布正确的是( )
| A. | Na  | B. | K  | C. | Xe | D. | Cl- |
20.已知A是一种金属单质,B显淡黄色,其转化关系如图所示,则C的以下性质错误的是( )
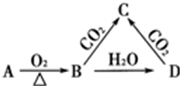

| A. | 与足量盐酸反应放出气体 | B. | 与澄清石灰水反应产生白色沉淀 | ||
| C. | 与氯化钙溶液不反应 | D. | 溶液呈碱性 |