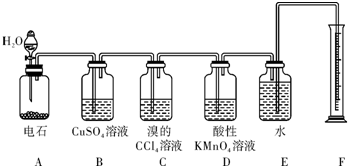
题目内容
1.有关晶体的叙述中正确的是( )| A. | 在SiO2晶体中,由Si、O构成的最小单元环中共有8个原子 | |
| B. | 在28g晶体硅中,含Si-Si共价键个数为4NA | |
| C. | 金刚石的熔沸点高于晶体硅,是因为C-C键键能小于Si-Si键 | |
| D. | 镁型和铜型金属晶体的配位数均为12 |
分析 A.在SiO2晶体中,由Si、O构成的最小单元环中共有12个原子;
B.28g晶体硅的物质的量为$\frac{28g}{28g/mol}$=1mol,每个Si原子占有两个Si-Si键;
C.原子晶体中,键能越大、键长越短,其熔沸点越高;
D.Mg是六方最密堆积、Cu是面心六方最密堆积,Cu晶体中Cu原子配位数=3×8×$\frac{1}{2}$,Mg晶体中Mg原子配位数=4×6×$\frac{1}{2}$.
解答 解:A.在SiO2晶体中,每个环上有6个Si原子,每2个Si原子之间含有一个O原子,所以由Si、O构成的最小单元环中共有12个原子,故A错误;
B.28g晶体硅的物质的量为$\frac{28g}{28g/mol}$=1mol,每个Si原子占有两个Si-Si键,所以在28g晶体硅中,含Si-Si共价键个数为2NA,故B错误;
C.原子晶体中,键能越大、键长越短,其熔沸点越高,金刚石的熔沸点高于晶体硅,是因为C-C键键长小于Si-Si键、C-C键能大于Si-Si,故C错误;
D.Mg是六方最密堆积、Cu是面心六方最密堆积,Cu晶体中Cu原子配位数=3×8×$\frac{1}{2}$=12,Mg晶体中Mg原子配位数=4×6×$\frac{1}{2}$=12,故D正确;
故选D.
点评 本题考查基本计算、原子晶体熔沸点比较、化学键的计算等知识点,侧重考查学生分析计算、空间想象能力,知道金刚石、二氧化硅最小环上原子个数,难点是Mg晶体配位数的计算方法.

练习册系列答案
相关题目
11.向含a mol H2SO4的质量分数为98%的浓硫酸中加入足量的铜片并加热,充分反应后有b mol H2SO4被还原,则a和b的关系是( )
| A. | a=b | B. | a=2b | C. | a/2<b<a | D. | a>2b |
12.有关乙烯有下列叙述:①乙烯溶于水后可得乙醇 ②乙烯能发生加聚反应 ③乙烯能与溴水发生加成反应 ④乙烯是无色难溶于水的气体 其中正确的是( )
| A. | 只有② | B. | ①和③ | C. | ②和③ | D. | ②③④ |
6.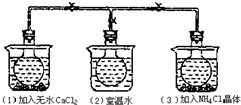 如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )
如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )
 如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )
如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯中.在(1)中加入无水CaCl2,在(3)中加入NH4Cl晶体,(2)中不加任何物质,发现(1)中NO2红棕色变深,(3)中NO2红棕色变浅,下列叙述不正确的是( )| A. | CaCl2溶于水时放出热量 | B. | 烧瓶(1)中气体的压强增大 | ||
| C. | NH4Cl溶于水时放出热量 | D. | 烧瓶(3)中气体的压强减小 |
13.下列各组中的两种粒子所含电子数相等的是( )
| A. | CH3+和NH4+ | B. | OH-和NH2- | C. | NO2和NO3- | D. | CH4和Na |
11.下列关于有机物的叙述正确的是( )
| A. | 煤经过分馏可得到焦炉气、煤焦油和焦炭 | |
| B. | 甲烷、汽油、酒精都是碳氢化合物,都可作燃料 | |
| C. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| D. | 蛋白质、淀粉、油脂均能发生水解反应 |
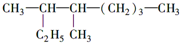 的名称是3,4一二甲基辛烷,
的名称是3,4一二甲基辛烷, ,1mol该烃完全燃烧需消耗氧气18.5mol,
,1mol该烃完全燃烧需消耗氧气18.5mol,