题目内容
V2O5是接触法制硫酸的重要催化剂,工业上生产V2O5的工艺流程如下:请回答下列问题:

(1)步骤①所得废渣的成分是 (写化学式),它与NaOH溶液反应的离子反应方程式为 .
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层),
①实验室中步骤②、③使用的主要仪器是 .
②中萃取时必须加入适量碱,其原因是 .
(3)步骤③中X试剂为 ,步骤④的目的是 ,步骤⑤的离子方程式为 .
(4)该工艺流程中,可以循环利用的物质有 和 .

(1)步骤①所得废渣的成分是
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n(水层)+2nHA(有机层)?2RAn(有机层)+nH2SO4(水层),
①实验室中步骤②、③使用的主要仪器是
②中萃取时必须加入适量碱,其原因是
(3)步骤③中X试剂为
(4)该工艺流程中,可以循环利用的物质有
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:(1)二氧化硅不与酸反应,过滤得到滤渣为二氧化硅;二氧化硅与氢氧化钠溶液反应生成了硅酸钠和水,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O;
(2)步骤②、③是萃取、分液,使用的主要仪器是分液漏斗;②中萃取时必须加入适量碱,会和平衡中的氢离子反应促进平衡正向进行;
(3)③中反萃取时加入的X试剂是抑制平衡正向进行;步骤④的目的是用氯酸钾将VO2+氧化为VO3-,步骤⑤氨水与酸反应的离子方程式为:NH3?H2O+H+=NH4++H2O;
(4)分析流程图,物质参加反应,反应过程中又生成可以循环利用;
(2)步骤②、③是萃取、分液,使用的主要仪器是分液漏斗;②中萃取时必须加入适量碱,会和平衡中的氢离子反应促进平衡正向进行;
(3)③中反萃取时加入的X试剂是抑制平衡正向进行;步骤④的目的是用氯酸钾将VO2+氧化为VO3-,步骤⑤氨水与酸反应的离子方程式为:NH3?H2O+H+=NH4++H2O;
(4)分析流程图,物质参加反应,反应过程中又生成可以循环利用;
解答:
解:(1)废钒催化剂(主要成分V2O5、Fe2O3和SiO2等)酸溶后,V2O5、Fe2O3和酸反应,二氧化硅不与酸反应,过滤得到滤渣为二氧化硅,二氧化硅与氢氧化钠溶液反应生成了硅酸钠和水,反应的离子方程式为:SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2;SiO2+2OH-=SiO32-+H2O;
(2)①实验室中步骤②、③是萃取、分液,使用的主要仪器是分液漏斗;故答案为:分液漏斗;
②分析平衡,Rn+(水层)+nHA(有机层)?RAn(有机层)+nH+(水层),加入的碱会中和氢离子促进平衡正向进行,提高了钒的萃取率;
故答案为:加入的碱会中和氢离子促进平衡正向进行,提高了钒的萃取率;
(3)③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行;步骤④的目的是用氯酸钾将VO2+氧化为VO3-,
步骤⑤氨水与酸反应的离子方程式为:NH3?H2O+H+=NH4++H2O,
故答案为:硫酸;用氯酸钾将VO2+氧化为VO3-,NH3?H2O+H+=NH4++H2O;
(4)分析流程图,物质参加反应,反应过程中又生成的物质,或重复利用的物质可以循环利用,流程中有机萃取剂、氨气可以循环利用,
故答案为:有机萃取剂;氨气.
故答案为:SiO2;SiO2+2OH-=SiO32-+H2O;
(2)①实验室中步骤②、③是萃取、分液,使用的主要仪器是分液漏斗;故答案为:分液漏斗;
②分析平衡,Rn+(水层)+nHA(有机层)?RAn(有机层)+nH+(水层),加入的碱会中和氢离子促进平衡正向进行,提高了钒的萃取率;
故答案为:加入的碱会中和氢离子促进平衡正向进行,提高了钒的萃取率;
(3)③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行;步骤④的目的是用氯酸钾将VO2+氧化为VO3-,
步骤⑤氨水与酸反应的离子方程式为:NH3?H2O+H+=NH4++H2O,
故答案为:硫酸;用氯酸钾将VO2+氧化为VO3-,NH3?H2O+H+=NH4++H2O;
(4)分析流程图,物质参加反应,反应过程中又生成的物质,或重复利用的物质可以循环利用,流程中有机萃取剂、氨气可以循环利用,
故答案为:有机萃取剂;氨气.
点评:本题考查了流程分析判断,物质性质和实验设计的方法应用,题干信息分析判断能力,掌握基础是关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列分子内部都存在着极性键的一组物质是( )
| A、H2S、NH3、SO3 |
| B、CO2、NH4Cl、Na2O2 |
| C、N2、CS2、NO |
| D、CaO、H2O2、CH4 |
下列各项数据中,其比值为2:1的是( )
| A、Na2S溶液中c(Na+)与c(S2-)之比 |
| B、相同温度下,0.2mol/LCH3COOH溶液与0.1mol/LCH3COOH溶液中c(H+)之比 |
| C、pH等于7的氨水与硫酸铵的混合溶液中c(NH4+)与c(SO4-)之比 |
| D、pH=12的KOH溶液与pH=12的Ba(OH)2溶液中c(OH?)之比 |
下列离子方程式正确的是( )
| A、氮化镁投入过量盐酸 Mg3N2+6H+═3Mg2++2NH3↑ |
| B、用硫氰化钾溶液检验溶液中的Fe3+:Fe3++3SCN-═Fe(SCN)3↓ |
| C、用双氧水和稀硫酸处理印刷电路板:Cu+H2O2+2H+═Cu2++2H2O |
| D、硫酸铜溶液中滴加过量的氨水:Cu2++2 NH3?H2O═Cu(OH)2↓+2NH4+ |
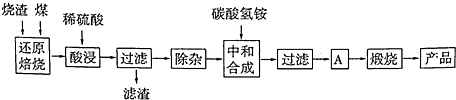
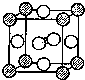 X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素.
X、Y、D、E、M、N是原子序数依次增大的前四周期元素,其中X是周期表中原子半径最小的元素,Y元素基态原子的三个能级上电子数目相同,E是地壳中含量最多的元素,M是制常见不锈钢材料的第一主要合金元素,其基态原子核外的未成对电子数在同周期元素中最多,N是目前用量最大的金属元素. 表示,镍原子用
表示,镍原子用 表示,镁原子用
表示,镁原子用 表示),则该晶体的化学式:
表示),则该晶体的化学式:
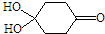 )分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为
)分子间脱水而得;一定条件下,M发生1个-OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为
 ).
). )发生类似反应①的反应,其生成物的结构简式为
)发生类似反应①的反应,其生成物的结构简式为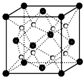 (1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.
(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6](NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等.