题目内容
2.设NA为阿伏加德罗常数的数值,下列说法正确的是( )| A. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 5.6g铁粉与足量水蒸气反应生成的H2分子数目为0.1NA | |
| C. | 向0.1mol/L的FeBr2溶液中通入适量Cl2,当c (Br-)=0.1mol/L时,消耗Cl2的分子数为0.1NA | |
| D. | 在反应Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,每生成1molCu,转移电子的数目为2NA |
分析 A.SO2和O2的反应为可逆反应;
B.依据铁和水蒸气反应的定量关系计算分析;
C.向0.1mol/L的FeBr2溶液中通入适量Cl2,溶液中离子还原性Fe2+>Br-,氯气先和亚铁离子反应再和溴离子反应,溶液体积不知不能计算消耗氯气分子数;
D.反应中Cu元素化合价由+1价将低到0价,O元素化合价由0价降低到-2价,S元素化合价由-2价升高到+4价.
解答 解:A.SO2和O2的反应为可逆反应,不能进行彻底,故所得体系中分子个数大于2NA个,故A正确;
B.依据铁和水蒸气反应的定量关系计算,5.6g铁粉物质的量为0.1mol,与足量水蒸气反应,3Fe+4H2O=Fe3O4+4H2,生成的H2分子数为$\frac{0.4}{3}$NA,故B错误;
C.2Fe2++Cl2=2Fe3++2Cl-,Cl2+2Br-=Br2+2Cl-,向0.1mol/L的FeBr2溶液中通入适量Cl2,当c (Br-)=0.1mol/L时,亚铁离子全部被氧化,溶液体积不知不能计算消耗Cl2的分子数,故C错误;
D.反应中Cu元素化合价由+1价将低到0价,O元素化合价由0价降低到-2价,S元素化合价由-2价升高到+4价,由方程式可知生成2molCu,转移6mol电子,则该反应中每生成1molCu,转移3NA电子,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的应用,主要是可逆反应、氧化还原反应电子转移计算,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
12.下列烷烃分子中去掉一个氢原子后所得的烃基只有一种的是( )
| A. | 甲烷 | B. | 戊烷 | C. | 丙烷 | D. | 丁烷 |
13.下列物质中,其主要成分不属于烃的是( )
| A. | 汽油 | B. | 生物柴油 | C. | 煤油 | D. | 润滑油 |
10.下列化合物的俗称与化学式不对应的是( )
| A. | 绿矾-FeSO4•7H2O | B. | 石膏-CaSO4•2H2O | ||
| C. | 明矾-Al2(SO4)3•12H2O | D. | 胆矾-CuSO4•5H2O |
17.0.1mol/LHF溶液的pH=2,则该溶液中有关浓度关系式正确的是( )
| A. | c(H+)>c(F-) | B. | c(H+)>c(HF) | C. | c(OH-)>c(H+) | D. | c(F-)>c(HF) |
14.如表实验操作能够达到实验目的是( )
| 实验操作 | 实验目的 | |
| A | 取绿豆大小、等体积的钠块分别投入等体积的水和乙醇中 | 证明乙醇烃基中的氢原子不如水分子中的氢原子活泼 |
| B | 将形状、大小均相等的铁片分别投入等体积的稀硫酸和浓硫酸中 | 证明溶液浓度越大,反应速度越快 |
| C | 将石蜡在催化作用下加强热,产生的气体通入溴的四氯化碳溶液中 | 证明石蜡分解产物是乙烯 |
| D | 向蔗糖溶液中加入稀硫酸,水浴加热一段时间,再加入新制的氢氧化铜悬浊液,用酒精灯加热 | 证明蔗糖水解可以生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
11.已知酸性KMnO4溶液可氧化C2H4生成CO2气体.则下列可用来鉴别CH4和C2H4,又可除去CH4中混有C2H4的方法是( )
| A. | 通入H2后加热 | B. | 通入酸性KMnO4溶液中 | ||
| C. | 通入足量的溴水中 | D. | 点燃 |
12.下列关于环境、能源和材料的叙述中,错误的是( )
| A. | 光导纤维是以二氧化硅为主要原料制成的 | |
| B. | 在西部和沿海地区兴建风力发电站,解决能源短缺问题 | |
| C. | 糖类、油脂、蛋白质都属于天然有机高分子化合物 | |
| D. | 铁质器具表面刷漆或将其置于干燥处保存,均能有效减缓铁的锈蚀 |

 .
.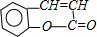 +H2O$\stackrel{酸}{→}$
+H2O$\stackrel{酸}{→}$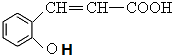 .
.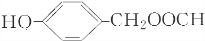 、
、 .
. 合成
合成