题目内容
甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应来制备甲醇.
Ⅰ:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.0kJ?mol-1
Ⅱ:CO(g)+2H2(g)?CH3OH(g)△H=-129.0kJ?mol-1
(l)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 .
(2)将1.0mol CH4和1.0mol H2O(g)通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.
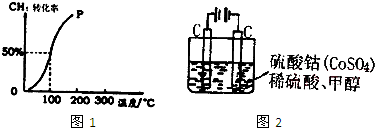
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 .
②100℃时反应I的平衡常数为 .
(3)在压强为0.1MPa、温度为300℃条件下,将a mol CO与2a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的
,其他条件不变,对平衡体系产生的影响是 (填字母序号)
A.平衡常数K增大 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡
减小
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂再把水中的甲醇氧化成CO2而净化.
若图2装置中的电源为甲醇一空气-KOH溶液的燃料电池,则电池正极的电极反应式: ,该电池工作时,溶液中的OH-向 极移动.净化合1mol甲醇的水,燃料电池转移电子 mol.
Ⅰ:CH4(g)+H2O(g)?CO(g)+3H2(g)△H=+206.0kJ?mol-1
Ⅱ:CO(g)+2H2(g)?CH3OH(g)△H=-129.0kJ?mol-1
(l)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为
(2)将1.0mol CH4和1.0mol H2O(g)通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.

①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为
②100℃时反应I的平衡常数为
(3)在压强为0.1MPa、温度为300℃条件下,将a mol CO与2a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的
| 1 |
| 2 |
A.平衡常数K增大 B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加 D.重新平衡
| c(H2) |
| c(CH3OH) |
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂再把水中的甲醇氧化成CO2而净化.
若图2装置中的电源为甲醇一空气-KOH溶液的燃料电池,则电池正极的电极反应式:
考点:热化学方程式,化学电源新型电池,化学平衡常数的含义,化学平衡的影响因素
专题:基本概念与基本理论
分析:(1)根据盖斯定律书写热化学方程式;
(2)100℃时达到平衡时,甲烷转化率为50%,结合化学平衡三段式列式计算平衡时各组分的物质的量;
①根据c=
计算v(H2);
②计算平衡状态时各物质的浓度,代入平衡常数表达式计算;
(3)其他条件不变,平衡后将容器的容积压缩到原来的
,压强增大,正、逆反应速率都增大,但正反应速率增大更多,平衡向正反应方向移动,生成物的浓度增大,由于温度不变,则平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,据此分析解答;
(4)甲醇一空气-KOH溶液的燃料电池中,燃料在负极失电子发生氧化反应生成碳酸盐,正极是氧气得到电子生成氢氧根离子,工作时原电池中阴离子移向负极,依据电极反应和电子守恒计算分析;
(2)100℃时达到平衡时,甲烷转化率为50%,结合化学平衡三段式列式计算平衡时各组分的物质的量;
①根据c=
| ||
| △t |
②计算平衡状态时各物质的浓度,代入平衡常数表达式计算;
(3)其他条件不变,平衡后将容器的容积压缩到原来的
| 1 |
| 2 |
(4)甲醇一空气-KOH溶液的燃料电池中,燃料在负极失电子发生氧化反应生成碳酸盐,正极是氧气得到电子生成氢氧根离子,工作时原电池中阴离子移向负极,依据电极反应和电子守恒计算分析;
解答:
解:(1)I:CH4 (g)+H2O (g)=CO (g)+3H2 (g)△H=+206.0kJ?mol-1
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ?mol-1
依据盖斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ?mol-1
故答案为:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77.0kJ?mol-1;
(2)将1.0mol CH4和1.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 1.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 0.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=
=0.003 mol?L-1?min-1,
故答案为:0.003 mol?L-1?min-1;
②100℃时反应I的平衡浓度为c(CH4)=0.005mol/L,c(H2O)=0.005mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,
平衡常数K=
=6.75×10-4,
故答案为:6.75×10-4;
(3)A.平衡后将容器的容积压缩到原来的
,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故A错误;
B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误;
C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确;
D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡
减小,故D正确;
故答案为:CD;
(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水,负极电极反应式为:CH3OH-6e-+8OH-═CO32-+6H2O,正极是氧气得到电子生成氢氧根离子,电极反应为O2+2H2O+4e-=4OH-,净化含1mol甲醇的水,燃料电池转移电子6mol:
故答案为:O2+2H2O+4e-=4OH-,负,6;
II:CO (g)+2H2 (g)=CH3OH (g)△H=-129.0kJ?mol-1
依据盖斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ?mol-1
故答案为:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77.0kJ?mol-1;
(2)将1.0mol CH4和1.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4 (g)+H2O (g)=CO (g)+3H2 (g)
起始量(mol):1.0 1.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 0.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率=
| ||
| 5min |
故答案为:0.003 mol?L-1?min-1;
②100℃时反应I的平衡浓度为c(CH4)=0.005mol/L,c(H2O)=0.005mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,
平衡常数K=
| 0.005×0.0153 |
| 0.005×0.005 |
故答案为:6.75×10-4;
(3)A.平衡后将容器的容积压缩到原来的
| 1 |
| 2 |
B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误;
C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确;
D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡
| c(H2) |
| c(CH3OH) |
故答案为:CD;
(4)负极发生氧化反应,甲醇在负极失去电子,碱性条件下生成碳酸根与水,负极电极反应式为:CH3OH-6e-+8OH-═CO32-+6H2O,正极是氧气得到电子生成氢氧根离子,电极反应为O2+2H2O+4e-=4OH-,净化含1mol甲醇的水,燃料电池转移电子6mol:
故答案为:O2+2H2O+4e-=4OH-,负,6;
点评:本题考查热化学方程式书写、化学平衡图象、影响化学平衡因素、平衡常数与反应速率计算、原电池等,掌握基础是解本题的关键,题目难度中等

练习册系列答案
相关题目
同温同压下,等质量的下列气体物质的量最大的是( )
| A、O2 |
| B、CH4 |
| C、CO2 |
| D、SO2 |
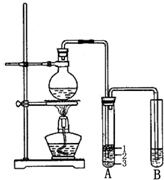 实验室制取少量溴乙烷的装置如图所示.
实验室制取少量溴乙烷的装置如图所示.