��Ŀ����
����Ŀ����һ������I1��ָ��̬ԭ��X��g��ʧȥһ�����ӳ�Ϊ��̬������X+��g�������������ͼ�Dz���Ԫ��ԭ�ӵĵ�һ������I1��ԭ�������仯������ͼ�� ��ش��������⣺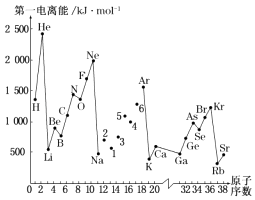
��1����ͼ������֪��ͬһ����Ԫ��ԭ�ӵĵ�һ������I1�ı仯������ ��
��2��ͼ��5��Ԫ�������ڱ��е�λ������ ��
��3��ͼ��4��5��6����Ԫ�ص���̬�⻯��ķе����ͬ������һ���ڵ�Ԫ����̬�⻯��ͺܶ࣬ԭ���ǣ� ��
��4����̬�ԭ��ʧȥ���ⲻͬ��������������ֱ�Ϊ��ʧȥ��һ����Ϊ519kJmol��1 �� ʧȥ�ڶ�������Ϊ7296kJmol��1 �� ʧȥ����������Ϊ11 799kJmol��1 �� �ɴ����ݷ���Ϊ���ԭ��ʧȥ����ڶ�������ʱ���������ҪԶԶ����ʧȥ��һ��������������� ��
���𰸡�
��1�����ϵ������μ�С
��2���������ڣ���A��
��3��NH3��H2O��HF�����ڴ��������������̬�⻯����۷е��
��4���ԭ��ʧȥһ�����Ӻ�Li+���γ��ȶ��ṹ����ʱ��ʧȥ���Ӻ�����
���������⣺��1��ͬһ����Ԫ��ԭ�ӵĵ�һ������I1 �� ����ͼ�Եڢ�A��Ϊ�����仯���ɴ��ϵ������μ�С��������һ�£� ���Դ��ǣ����ϵ������μ�С����2��5��Ԫ��Ϊ15��Ԫ�ص��������ڱ��е�λ��Ϊ�������ڣ��ڢ�A�壬
���Դ��ǣ��������ڣ���A�壻��3����һ���ڵ�Ԫ�ص��⻯��ֱ�ΪNH3��H2O��HF�����Ӽ������������Է����۷е�ϸߣ�
���Դ��ǣ�NH3��H2O��HF�����ڴ��������������̬�⻯����۷е�ߣ���4���ԭ��ʧȥ����ڶ�������ʱ���������ҪԶԶ����ʧȥ��һ��������������������ԭ��ʧȥһ�����Ӻ�Li+���γ��ȶ��ṹ����ʱ��ʧȥ���Ӻ����ѣ�
���Դ��ǣ��ԭ��ʧȥһ�����Ӻ�Li+���γ��ȶ��ṹ����ʱ��ʧȥ���Ӻ����ѣ�

����Ŀ����ͬԪ�ص�ԭ���ڷ������������ӵ�������С����һ��ֵX����ʾ����XԽ����ԭ���������ӵ�����Խǿ�������γɵķ����г�Ϊ�����һ����������ijЩ������Ԫ�ص�Xֵ��
Ԫ�� | Li | Be | B | C | O | F |
Xֵ | 0.98 | 1.57 | 2.04 | 2.53 | 3.44 | 3.98 |
Ԫ�� | Na | Al | Si | P | S | Cl |
Xֵ | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
��1��ͨ������Xֵ�ı仯���ɣ�ȷ��N��Mg��Xֵ��Χ����X��Mg������ ��X��N���� ��
��2���Ʋ�Xֵ��ԭ�Ӱ뾶�Ĺ�ϵ�� ��
��3��ij�л���ṹ��ʽΪ ![]() ����S��N�У�����Ϊ���õ��Ӷ�ƫ��˭����дԭ�����ƣ���
����S��N�У�����Ϊ���õ��Ӷ�ƫ��˭����дԭ�����ƣ���
��4��������ɸ������ǵ��ɼ�����ԭ����ӦԪ�ص縺�ԵIJ�ֵ��X��1.7ʱ��һ��Ϊ���Ӽ�������X��1.7ʱ��һ��Ϊ���ۼ������ƶ�AlBr3�л�ѧ����������
��5��Ԥ��Ԫ�����ڱ��У�Xֵ��С��Ԫ��λ����������Ԫ�س��⣩��