题目内容
下列关于自发反应的说法中正确的是( )
| A、在一定条件下,自发反应的逆过程一定是非自发的 |
| B、自发反应一定能进行,非自发反应一定不能进行 |
| C、自发反应一定能进行彻底 |
| D、可以通过改变温度或加催化剂的办法使非自发反应转变为自发反应 |
考点:焓变和熵变
专题:化学反应中的能量变化
分析:A、反应自发进行的判断依据是△H-T△S<0,正逆反应的△H-T△S的符号相反;
B、有些自发进行的反应也需要反应条件;
C、可逆反应不能进行到底;
D、催化剂对反应自发性无响应.
B、有些自发进行的反应也需要反应条件;
C、可逆反应不能进行到底;
D、催化剂对反应自发性无响应.
解答:
解:A、反应自发进行的判断依据是△H-T△S<0,若正方向为自发反应,则逆反应△H-T△S>0,逆反应一定是非自发反应,故A正确;
B、有些自发进行的反应也需要反应条件,才能进行,如氢气和氧气需要点燃反应,非自发反应在一定条件下也能进行,故B错误;
C、对应自发进行的可逆反应,反应不能进行彻底,故C错误;
D、催化剂只改变反应所需的活化能,不改变反应热,所以对△H-T△S的值无影响,则对反应的自发性无影响,故D错误;
故选C.
B、有些自发进行的反应也需要反应条件,才能进行,如氢气和氧气需要点燃反应,非自发反应在一定条件下也能进行,故B错误;
C、对应自发进行的可逆反应,反应不能进行彻底,故C错误;
D、催化剂只改变反应所需的活化能,不改变反应热,所以对△H-T△S的值无影响,则对反应的自发性无影响,故D错误;
故选C.
点评:本题考查了化学反应自发进行大判断依据和条件分析,反应是否自发进行需要焓变、熵变、温度共同决定,题目难度不大.

练习册系列答案
相关题目
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6.下列说法正确的是( )
| A、Y元素最高价氧化物对应的水化物化学式H2YO4 |
| B、原子半径由大到小的顺序为:W>Z>Y |
| C、X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 |
| D、X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:1 |
将20mL 0.5mol?L-1盐酸与一块状大理石反应,下列的措施不能提高化学反应速率的是( )
| A、加入10mL 3mol?L-1盐酸 |
| B、给反应混合物加热 |
| C、将所用的大理石研磨成粉末 |
| D、加入10mL蒸馏水 |
用固体氯化钠配制浓度为1.00mol/L的氯化钠溶液100mL,用不到的仪器是( )
| A、托盘天平 | B、容量瓶 |
| C、玻璃棒 | D、试管 |
用价层电子对互斥理论预测CO32-和BF3的立体结构分别是( )
| A、平面三角形;三角锥形 |
| B、三角锥形;平面三角形 |
| C、三角锥形;三角锥形 |
| D、平面三角形;平面三角形 |
下列反应的离子方程式书写正确的是( )
| A、电解饱和食盐水:2Cl-+2H+=H2↑+Cl2↑ |
| B、浓盐酸与二氧化锰反应制氯气:MnO2+2Cl-+2H+=Cl2↑+Mn2++H2O |
| C、用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O |
| D、向溴化亚铁溶液中通入过量的氯气:2Fe2++Cl2=2Cl-+2Fe3+ |
以下四种有机物的分子式皆为C4H10O:
①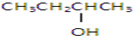
②CH3CH2CH2CH2OH
③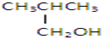
④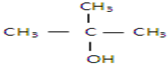
其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
①
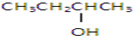
②CH3CH2CH2CH2OH
③
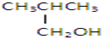
④
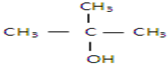
其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
| A、①② | B、只有② |
| C、②和③ | D、③和④ |
下列叙述中,正确的是( )
| A、12g碳所含的原子数就是阿伏加德罗常数 |
| B、阿伏加德罗常数没有单位 |
| C、“物质的量”指物质的质量 |
| D、摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒 |
下列反应中,不能用2H++CO32-=H2O+CO2↑表示的反应是( )
| A、2HCl+Na2CO3=H2O+CO2↑+2NaCl |
| B、NaHCO3+HCl=NaCl+CO2↑+H2O |
| C、H2SO4+K2CO3=H2O+CO2↑+2KCl |
| D、2HNO3+K2CO3=H2O+CO2↑+2KNO3 |