题目内容
12.设NA为阿伏加德罗常数的值,下列各项叙述正确的是( )①1molCl2参加反应转移电子数一定为2NA
②1mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA
③标准状况下,44.8L NO与22.4LO2混合后气体中分子总数为2NA
④1L 2mol•L-1的Al(NO3)3溶液中含Al3+个数为2NA
⑤1L 2mol/L的氯化铁溶液完全制成胶体,氢氧化铁胶体的粒子数小于2NA
⑥6.0g SiO2晶体中含有的硅氧键数目为0.4NA
⑦1molCH5+所含的电子数为10NA
⑧在标准状况下,2.8g N2和2.8g CO所含电子数均为1.4NA
⑨300mL 2mol/L蔗糖溶液中所含分子数为0.6NA
⑩标准状况下,2.24L乙醇分子所含的C-H键数为 0.5NA.
| A. | ②③⑦⑧⑨⑩ | B. | ①②③⑤⑧⑨ | C. | ②⑤⑥⑦⑧ | D. | ②④⑦⑧⑩ |
分析 ①Cl2参加反应后的价态不明确;
②Na2O和Na2O2均由2个阳离子和1个阴离子构成;
③标准状况下,44.8L NO与22.4LO2的物质的量分别为2mol和1mol,反应生成的NO2气体中存在平衡:2NO2?N2O4;
④Al3+为弱碱阳离子,在溶液中会水解;
⑤一个氢氧化铁胶体是多个氢氧化铁的聚合体;
⑥求出SiO2晶体的物质的量,然后根据1mol二氧化硅中含4mol硅氧键来分析;
⑦CH5+中含10个电子;
⑧N2和CO的摩尔质量均为28g/mol,且均含14个电子;
⑨蔗糖溶液中除了蔗糖分子,还有水分子;
⑩标准状况下,乙醇为液态.
解答 解:①Cl2参加反应后的价态不明确,故1mol氯气反应后转移的电子数无法计算,故错误;
②Na2O和Na2O2均由2个阳离子和1个阴离子构成,故1mol混合物中含阳离子为2mol、阴离子为1mol,即共含3NA个离子,故正确;
③标准状况下,44.8L NO与22.4LO2的物质的量分别为2mol和1mol,反应生成的2molNO2气体中存在平衡:2NO2?N2O4,导致分子个数小于2NA个,故错误;
④Al3+为弱碱阳离子,在溶液中会水解,故溶液中的铝离子的个数小于2NA个,故错误;
⑤一个氢氧化铁胶体是多个氢氧化铁的聚合体,故形成的胶粒的个数小于2NA个,故正确;
⑥6.0gSiO2晶体的物质的量为1mol,而1mol二氧化硅中含4mol硅氧键,故0.1mol二氧化硅中含0.4mol硅氧键即0.4NA个,故错误;
⑦CH5+中含10个电子,故1mol中含10NA个电子,故正确;
⑧N2和CO的摩尔质量均为28g/mol,且均含14个电子,故2.8g氮气和2.8gCO的物质的量均为0.1mol,且均含1.4NA个电子,故正确;
⑨蔗糖溶液中除了蔗糖分子,还有水分子,故溶液中含有的分子数大于0.6NA个,故错误;
⑩标准状况下,乙醇为液态,故不能根据气体摩尔体积来计算其物质的量和C-H键个数,故错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

(1)该同学最初的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| Ⅰ | 向2 mL 0.1 mol/LFeCl2溶液中滴加KSCN溶液,再滴加氯水 | |
| Ⅱ | 向2 mL 0.1 mol/L FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol/L KI溶液 | 滴加KSCN溶液后,溶液变成红色; 滴加KI溶液后,红色无明显变化 |
②FeCl2溶液与新制氯水反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-.
(2)该同学分析了导致实验Ⅱ现象的可能原因,并对实验方案进行了改进.改进后的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| Ⅲ | 向2 mL 0.1 mol/L KI溶液中滴加1 mL 0.1 mol/L FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色; 滴加KSCN溶液后,溶液变成红色 |
(3)该同学认为需要进一步设计实验证明根据实验Ⅲ中现象得出的结论.请补全下表中的实验方案.
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2 mL 0.1 mol/L KI溶液中滴加 1 mL 0.1mol/L FeCl3溶液,或CCl4;或铁氰化钾溶液 | 溶液变蓝(或溶液分层,下层溶液为紫色;或生成蓝色沉淀),结论:Fe3+能与I-发生氧化还原反应,生成I2(或Fe2+) |
| A. | 溶液中c(H+)>c(OH-),且Kw=c(H+).c(OH-)=1×10-14mol2/L2 | |
| B. | 由水电离出来的H+浓度为1×10-14mol/L-1 | |
| C. | 溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 此溶液中由水电离出来的c(H+)=c(OH-) |
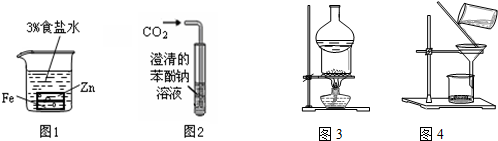
| A. | 图1中正极反应是Zn-2e-=Zn2+ | |
| B. | 图2可用于比较碳酸、苯酚酸性的强弱 | |
| C. | 图3可用于I2与NH4Cl混合物的分离 | |
| D. | 图4用于去除Fe(OH)3胶体中含有的可溶性物质 |
| A. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| B. | 用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏 | |
| C. | 在苯甲酸重结晶实验中,在冷却结晶过程中温度越低越好 | |
| D. | 在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后,要冷却到常温才过滤 |
| A. | 17.6 g 丙烷中所含的极性共价键为 4NA | |
| B. | 常温常压下,2.24 L 乙烯中电子总数为1.6NA | |
| C. | 溴乙烷加入NaOH溶液、加热再加入AgNO3有浅黄色沉淀生成 | |
| D. | 26克C2H2、苯、苯乙烯组成的混合物所含碳原子数为2NA |
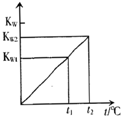 水的离子积常数KW与温度t(℃)的关系如图所示:
水的离子积常数KW与温度t(℃)的关系如图所示: