题目内容
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 基态原子中的未成对电子数是同周期中最多的 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题(用对应元素的元素符号作答):
(1)写出D元素基态原子的价电子排布式 , E2+价电子的轨道表示式。
(2)这5种元素中电负性最大的元素是(填元素符号),A、B、C三种元素的第一电离能由大到小的顺序为(填元素符号)
(3)B、C、D的简单离子的半径由大到小的顺序为(用离子符号表示)
(4)写出C的核外有18个电子的氢化物的电子式。
【答案】
(1)3s23p1;![]()
(2)O;N>O>C
(3)N3->O2->Al3+
(4)![]()
【解析】(1)Al元素的原子序数是13,其基态原子的价电子排布式为3s23p1 , Fe2+价电子的轨道表示式为 ![]() 。
。
(2)非金属性越强,电负性越大,则这5种元素中电负性最大的元素是O;非金属性越强,第一电离能越大,但由于氮元素的2p轨道电子处于半充满状态,稳定性强,则A、B、C三种元素的第一电离能由大到小的顺序为N>O>C。
(3)核外电子排布相同的离子,其离子半径随原子序数的增大而减小,则B、C、D的简单离子的半径由大到小的顺序为N3->O2->Al3+。
(4)氧元素的核外有18个电子的氢化物是双氧水,属于共价化合物,电子式为 ![]() 。 A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,由A的基态原子的价电子排布式可知,n=2,则A为C元素;C的最外层电子数是电子层数的3倍,则C为O元素;B的基态原子中的未成对电子数是同周期中最多的,可知p能级上只有3个电子,结合原子序数可知,B为N元素;D为简单离子是第三周期元素中离子半径最小的,则D为Al元素;E的价电子层中的未成对电子数为4,则E为Fe,电子排布式为[Ar]3d64s2 , 以此来解答.
。 A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,由A的基态原子的价电子排布式可知,n=2,则A为C元素;C的最外层电子数是电子层数的3倍,则C为O元素;B的基态原子中的未成对电子数是同周期中最多的,可知p能级上只有3个电子,结合原子序数可知,B为N元素;D为简单离子是第三周期元素中离子半径最小的,则D为Al元素;E的价电子层中的未成对电子数为4,则E为Fe,电子排布式为[Ar]3d64s2 , 以此来解答.

【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如图所示。回答下列问题:
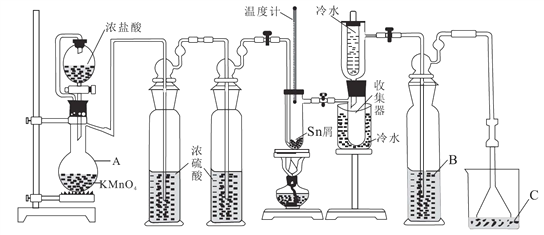
已知:①SnCl4在空气中极易水解生成SnO2·хH2O
②
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)仪器A的名称是_______,其中发生反应的离子方程式是____________。
(2)点燃酒精灯前需排尽装置中的空气,否则会发生副反应,化学方程式是______、_____。
(3)试剂 B、C依次为_______,试剂B的作用是______。
(4)Cl2 和锡的反应产物有SnCl4和SnCl2,为防止产品中带入 SnCl2,可采取的措施是_______、_______。
(5)碘氧化法滴定分析产品中2价Sn(II)的含量。准确称取m g产品于锥形瓶中,用蒸馏水溶解,淀粉-KI溶液做指示剂,用c mol·L-1 碘标准溶液滴定至终点,消耗碘标准溶液V mL,计算产品中Sn(II)的含量_______(用含c、m、V的代数式表示)。



