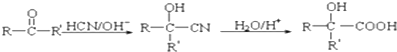题目内容
下列说法中正确的是( )
| A、强电解质一定是离子化合物,弱电解质一定是共价化合物 |
| B、强电解质是易溶化合物,弱电解质是不溶化合物 |
| C、三氧化硫溶于水后导电性很强,所以三氧化硫是强电解质 |
| D、强电解质的导电性不一定比弱电解质的导电性强 |
考点:强电解质和弱电解质的概念
专题:电离平衡与溶液的pH专题
分析:A、强电解质是指在水溶液中或熔融状态下能完全电离的化合物,弱电解质是在水溶液中部分电离的电解质;
B、硝酸银难溶于水,但它是强电解质,醋酸易溶于水,但它是弱酸,属于弱电解质;
C、三氧化硫不电离,三氧化硫和水反应生成硫酸,硫酸导电;
D、导电能力与离子的浓度有关,与电解质的强弱无关.
B、硝酸银难溶于水,但它是强电解质,醋酸易溶于水,但它是弱酸,属于弱电解质;
C、三氧化硫不电离,三氧化硫和水反应生成硫酸,硫酸导电;
D、导电能力与离子的浓度有关,与电解质的强弱无关.
解答:
解:A、强电解质不一定是离子化合物,如氯化氢是共价化合物,但它在水溶液中能完全电离,它是强电解质,故A错误;
B、强弱电解质和溶于水的电解质是否完全电离有关,与是否难易溶于水无关,硝酸银难溶于水,但它是强电解质,醋酸易溶于水,但它是弱酸,故B错误;
C、SO3溶于水和水结合成硫酸,硫酸是强电解质,三氧化硫是非电解质,故C错误;
D、导电能力与离子的浓度有关,与电解质的强弱无关,浓度大的弱电解质其导电性比浓度很小的强电解质溶液的导电性大,故D正确;
故选D.
B、强弱电解质和溶于水的电解质是否完全电离有关,与是否难易溶于水无关,硝酸银难溶于水,但它是强电解质,醋酸易溶于水,但它是弱酸,故B错误;
C、SO3溶于水和水结合成硫酸,硫酸是强电解质,三氧化硫是非电解质,故C错误;
D、导电能力与离子的浓度有关,与电解质的强弱无关,浓度大的弱电解质其导电性比浓度很小的强电解质溶液的导电性大,故D正确;
故选D.
点评:本题考查了强、弱电解质的判断,抓住强弱电解质的电离程度是解答本题的关键.难度不大.

练习册系列答案
 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
二甲苯的苯环上有一个氢原子被溴取代后的一溴代物有六种异构体,它们的熔点分别如下表所示.下列叙述正确的是( )
| 二甲苯一溴代物的熔点(℃) | 234 | 206 | 214 | 204 | 212 | 205 |
| 对应的二甲苯的熔点(℃) | 13 | -48 | -25 | -48 | -25 | -48 |
| A、熔点为234℃的是一溴代间二甲苯 |
| B、熔点为234℃的是一溴代邻二甲苯 |
| C、熔点为-48℃的是间二甲苯 |
| D、熔点为-25℃的是对二甲苯 |
2001年9月1日将执行国家食品卫生标准规定,酱油中3-氯丙醇(ClCH2CH2CH2OH)含量不得超过10-4%.相对分子质量为94.5的氯丙醇(已知-OH基和-Cl不能连在同一个碳原子上)共有( )
| A、2种 | B、3种 | C、4种 | D、5种 |
已知反应:①2C(s)+O2(g)=2CO(g);△H=-221kJ/mol②H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ/mol(稀溶液);下列结论正确的是( )
| A、碳的燃烧热为110.5 kJ/mol |
| B、1mol碳充分燃烧放出的热量大于110.5kJ |
| C、浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ |
| D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ |
下列说法中不正确的是( )
| A、普通玻璃呈淡绿色是由于含Fe2+ |
| B、坩埚、蒸发皿都属于陶瓷制品 |
| C、唐“三彩”是一种玻璃制品 |
| D、高温下硅酸钙比碳酸钙稳定 |
下列说法正确的是( )
| A、需要加热方能发生的反应一定是吸热反应 |
| B、放热的反应在常温下一定很易发生 |
| C、一个反应是放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定,而不是由反应是否需要加热而决定 |
| D、吸热反应发生过程中要不断从外界获得能量、放热反应发生过程中不再需要外界能量 |
将2.3g钠投入水中,要保证每100个水分子中溶有1个钠离子,加入的水的质量是( )
| A、180g |
| B、200.8g |
| C、230g |
| D、181.8g |