题目内容
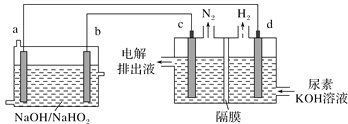
【题目】已知H2O2是一种弱酸,在强碱溶液中主要以![]() 形式存在。现以AlH2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法正确的是
形式存在。现以AlH2O2燃料电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(电解池中隔膜仅阻止气体通过,c、d均为惰性电极)。下列说法正确的是
A. 燃料电池的总反应为:2Al+3![]() 2
2![]() +2H2O
+2H2O
B. 电解时,Al消耗2.7 g,则产生氮气的体积为1.12 L
C. 电极b是负极,且反应后该电极区pH增大
D. 电解过程中,电子的流向:a→d,c→b
【答案】D
【解析】试题A、Al—H2O2燃料电池Al为负极,总反应为Al+3H2O2+OH-=AlO2-+HO2-+3H2O,错误;B、由CO(NH2)2→N2,每生成1molN2,转移6mol电子,需要消耗2molAl,故消耗2.7g Al (0.1mol Al)转移0.3mol电子,可生成0.05molN2,标准状况下体积为1.12L,题中没说是标准状况下,错误;C、根据电解池中d极产生H2应为H+放电,故d为阴极,所以a是负极,b为正极,正极区电极反应为H2O2结合OH-生成HO2-,所以pH减小,C错误;D、根据上面分析,a为负极故电子流向为a→d,c→b,正确。

练习册系列答案
相关题目