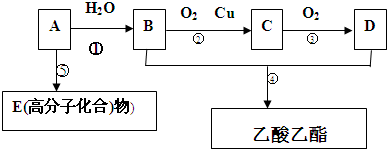
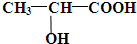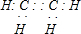题目内容
4.常温常压下,等质量的NO2和N2O4,二者的物质的量之比为2:1,原子个数之比为1:1,等物质的量混合后混合气体的平均相对分子质量为69.分析 因为二氧化氮的摩尔质量是四氧化二氮的摩尔质量的一半,所以等质量的NO2和N2O4,二者的物质的量之比为2:1,因为二氧化氮和四氧化二氮中氮和氧的原子个数之比为1:1,根据$\overline{M}$=$\frac{m}{n}$进行计算.
解答 解:因为二氧化氮的摩尔质量是四氧化二氮的摩尔质量的一半,所以等质量的NO2和N2O4,二者的物质的量之比为2:1,因为二氧化氮和四氧化二氮中氮和氧的原子个数之比为1:1,$\overline{M}$=$\frac{m}{n}$=$\frac{46×2+46}{2}$=69,故答案为:2:1;1:1;69.
点评 本题考查由相对分子质量求,两者的物质的量之比,然后根据体积之比等于物质的量之比,比较容易.

练习册系列答案
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案
相关题目
14.下列反应中,属于取代反应的是( )
| A. | 实验室制取乙烯 | |
| B. | 乙酸与乙醇在浓硫酸和加热条件下的酯化反应 | |
| C. | 葡萄糖与银氨溶液反应 | |
| D. | 乙醛和氢气的反应 |
15.95℃时水的离子积约为KW=1.0×10-12,pH=8的CH3COONa溶液中,由水电离出的OH-浓度是( )
| A. | 1×10-10mol•L-1 | B. | 1×10-8mol•L-1 | C. | 1×10-4mol•L-1 | D. | 1×10-6mol•L-1 |
19.下列关于苯酚的叙述,不正确的是( )
| A. | 将苯酚晶体放人少量水中,加热至全部溶解,冷却至50℃形成悬浊液 | |
| B. | 苯酚可以和硝酸发生取代反应 | |
| C. | 苯酚易溶于NaOH溶液中 | |
| D. | 苯酚的酸性比碳酸强,比醋酸弱 |
2.常温时,Ksp[Mg(OH)2]=1.1×10-11,Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.9×10-12,Ksp(CH3COOAg)=2.3×10-3,下列叙述不正确的是( )
| A. | 在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 | |
| B. | 浓度均为0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 | |
| C. | c(Mg2+)为0.11 mol•L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 将0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 |
9.食品香精菠萝酯的生产路线(反应条件略去)如下:

下列叙述错误的是( )

下列叙述错误的是( )
| A. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 | |
| B. | 苯酚、苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| C. | 步骤(1)中由苯酚生成苯氧乙酸的反应属于取代反应 | |
| D. | 可用溴水检验步骤(2)的产物中是否有烯丙醇(CH2=CHCH2OH) 残留 |
6.下列说法正确的是( )
| A. |  的系统命名法为2,5-二甲基-4-乙基己烷 的系统命名法为2,5-二甲基-4-乙基己烷 | |
| B. | 全降解塑料(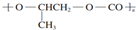 )可由单体环氧丙烷( )可由单体环氧丙烷(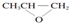 )和CO2加聚制得 )和CO2加聚制得 | |
| C. | 1mol乙酰水杨酸(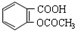 )最多可以和2molNaOH反应 )最多可以和2molNaOH反应 | |
| D. | 油脂、淀粉、蛋白质等高分子化合物都属于混合物,一定条件下均可发生水解 |
7.反应A+B═2C,在反应过程中,断裂1mol A中的化学键消耗的能量为Q1kJ,断裂1mol B中的化学键消耗的能量为Q2kJ,形成1mol C中的化学键释放的能量为Q3kJ;1mol A所含化学能为E1kJ,1mol B所含化学能E2kJ,1molC 所含化学能E3kJ.下列说法中一定正确的是( )
| A. | 若Q1+Q2<Q3,则反应为放热反应 | B. | 若Q1+Q2<2Q3,则反应为放热反应 | ||
| C. | 若E1+E2>E3,则反应为放热反应 | D. | 若E1+E2>E3,则反应为吸热反应 |