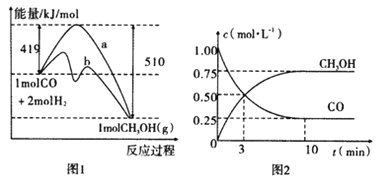
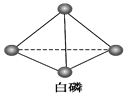
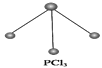
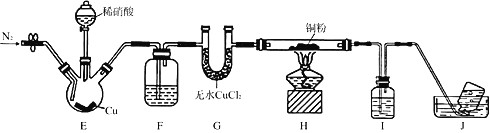
��Ŀ����
����Ŀ�����±���Ԫ�����ڱ���һ���֣����ݱ����г���10��Ԫ�أ��ش��������⡣

��1��O��S�У�ԭ�Ӱ뾶�ϴ����________��(��Ԫ�ط��Ż�ѧ������ͬ)
��2��CH4��NH3�У����ȶ��Խ�ǿ����________��
��3��������ˮ��Ư�����ã�����Ϊ���к���________��
��4��Ԫ������������Ӧˮ�����У���������������________________��
��5���ϱ�Ԫ���У��������������Ӧˮ����ļ�����ǿ����Һ���Լ�ƿ�Dz����ò���������д���÷�Ӧ�����ӷ���ʽ_______________��
�����в���Ԫ�ص�������ԭ�ӣ�����ӣ��ṹ���±���
Ԫ�ر�� | Ԫ��������ԭ�ӣ�����ӣ��ṹ |
T | �����������Ǵ�����������3�� |
X | �����µ���Ϊ˫ԭ�ӷ��ӣ������к���3�Թ��õ��Ӷ� |
Y | M���K����1������ |
Z | ��3����Ԫ�صļ������а뾶��С |
��1��Ԫ��T��Ԫ�����ڱ��е�λ����________________��
��2��Ԫ��Y��Ԫ��Z��ȣ������Խ�ǿ����______����Ԫ�ط��ű�ʾ�������б�������֤����һ��ʵ����______������ţ���
a��Y���ʵ��۵��Z���ʵ�
b��Y�Ļ��ϼ۱�Z��
c��Y������ˮ��Ӧ��Z���ʾ���
d��Y����������ˮ����ļ��Ա�Zǿ
��3����������Ԫ������2��Ԫ�����γ�һ�ֵ���ɫ�Ĺ��壬�û�����ĵ���ʽ��________________��������ѧ����������________________��
���𰸡� S NH3 HClO Al(OH)3 SiO2+2OH��= SiO32��+H2O ��2����VIA�� Na c d ![]() ���Ӽ������ۼ�����Ǽ��Լ���
���Ӽ������ۼ�����Ǽ��Լ���
������������Ԫ�������ڱ��е�λ�ã����Ԫ�ؼ��仯��������ʺ�Ԫ�������ɽ��
��Tԭ�ӵ������������Ǵ�����������3�����������������ܳ���8������T����Ԫ�أ�X�γɵĵ��ʳ�����Ϊ˫ԭ�ӷ��ӣ������к���3�Թ��õ��Ӷԣ��ǵ�������X�ǵ�Ԫ�أ�Yԭ�ӵ�M���K����1�����ӣ���Y����Ԫ�أ�Z�ǵ�3����Ԫ�صļ������а뾶��С�ģ�����Z����Ԫ�أ��ݴ˽��
��1��O��Sλ��ͬһ���壬���ϵ���ԭ�Ӱ뾶��������ԭ�Ӱ뾶�ϴ����S��
��2���ǽ�����N��C���ǽ�����Խǿ�����⻯����ȶ���Խǿ����CH4��NH3�У����ȶ��Խ�ǿ����NH3��
��3��������ˮ��Ư�����ã�����Ϊ���к���HClO�����������ǿ�����Զ���Ư�����ã�
��4��Ԫ������������Ӧˮ�����У���������������Al(OH)3��
��5��������Խǿ������������Ӧˮ����ļ���Խǿ������Ԫ��������������Ӧˮ����ļ�����ǿ����NaOH����ǿ�����������跴Ӧ������Ժ�ǿ�Ĺ����ƣ����ʢ������������Һ���Լ�ƿ�����ò���������Ӧ�ķ���ʽΪSiO2+2OH��=SiO32��+H2O��
�������Ϸ�����֪T��O��X��N��Y��Na��Z��Al����
��1����Ԫ����Ԫ�����ڱ��е�λ���ǵڶ�����VIA�塣
��2��ͬ�����������ҽ�������������Ԫ��Y��Ԫ��Z��ȣ������Խ�ǿ����Na��
a��������ǿ���뵥�ʵ��۵�ߵ�û�й�ϵ��a����
b��������ǿ����Ԫ�صĻ��ϼ۸ߵ�û�й�ϵ��b����
c��������Խǿ����ˮ���ᷴӦԽ���ң���Y������ˮ��Ӧ��Z���ʾ��ҿ���˵����������ǿ������c��ȷ��
d��������Խǿ������������Ӧˮ����ļ���Խǿ��Y����������ˮ����ļ��Ա�Zǿ����˵����������ǿ������d��ȷ��
��ѡcd��
��3����������Ԫ������2��Ԫ�����γ�һ�ֵ���ɫ�Ĺ��壬���������γɵĹ������ƣ��û�����ĵ���ʽ��![]() ��������ѧ�������������Ӽ������ۼ�����Ǽ��Լ�����
��������ѧ�������������Ӽ������ۼ�����Ǽ��Լ�����

����Ŀ��Ϊ̽��Na2SO3��Һ���������ڰ�ɫ��ΰ��a��b��c��d�ĸ������е���Na2SO3��Һ���ٷֱ�μ���ͼ��ʾ���Լ���

���й���ʵ������Ľ��ͻ������ȷ����
ѡ�� | ʵ������ | ���ͻ���� |
A | a������������ | Na2SO3��H2O2һ����������Ӧ |
B | b�м�ϡH2SO4��Ų�������ɫ���� | SO32��S2��������һ�����ܴ������� |
C | c�м�BaCl2��Һ�������ɫ�����Һ�ɫ��ȥ | Ba2++ SO32 == BaSO3����ʹSO32ˮ��ƽ�������ƶ�����ɫ��ȥ |
D | d�в�����ɫ���� | ԭNa2SO3��Һ�к���SO42 |
A. A B. B C. C D. D