题目内容
 氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.
氧元素和卤族元素都能形成多种物质,我们可以利用所学物质结构与性质的相关知识去认识和理解.(1)COCl2的空间构型为
(2)已知CsICl2不稳定,受热易分解,倾向于生成晶格能更大的物质,则它按下列
A. CsICl2=CsCl+ICl B. CsICl2=CsI+Cl2
(3)根据下表提供的第一电离能数据判断:最有可能生成较稳定的单核阳离子的卤素原子是
| 氖 | 氧 | 溴 | 碘 | |
| 第一电离能 (Kj/mol) | 1681 | 1251 | 1140 | 1008 |
A. HCl B.HF C. SO2 D. SCl2
(5)已知ClO2一为角型,中心氯原子周围有四对价层电子.ClO2-中心氯原子的杂化轨道类型为
(6)钙在氧气中燃烧时得到一种钙的氧化物品体,其结构如图所示:由此可判断该钙的氧化物的化学式为
考点:晶胞的计算,原子核外电子排布,判断简单分子或离子的构型,原子轨道杂化方式及杂化类型判断
专题:化学键与晶体结构
分析:(1)COCl2中C原子的价电子对数为
=3,C原子采取sp2杂化,中心原子无孤电子对,C与O原子之间形成C=O双键,其结构式是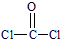 ,据此判断分子空间构型,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,据此写出价电子排布式;
,据此判断分子空间构型,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,据此写出价电子排布式;
(2)在离子晶体中离子半径越小,晶格能越大,据此判断;
(3)第一电离能是指原子失去一个电子所需的能量,第一电离能越小,就越容易失去一个电子,据此答题;
(4)A. HCl中存在s-pσ键,B.HF中存在s-pσ键,C. SO2中存在p-pπ键,D. SCl2中存在p-pσ键,据此答题;
(5)根据中心原子的价层电子对数确定其杂化方式;等电子体是具有相同的价电子数和相同原子数的微粒;
(6)根据均摊法确定晶胞中各种原子的个数,再确定其化学式,根据密度确定晶胞的体积,进而求得晶胞的边长,两个离得最近的钙是位于顶点和面心上的,它们的距离为晶胞边长的
,据此答题;
| 4+2 |
| 2 |
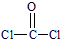 ,据此判断分子空间构型,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,据此写出价电子排布式;
,据此判断分子空间构型,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,据此写出价电子排布式;(2)在离子晶体中离子半径越小,晶格能越大,据此判断;
(3)第一电离能是指原子失去一个电子所需的能量,第一电离能越小,就越容易失去一个电子,据此答题;
(4)A. HCl中存在s-pσ键,B.HF中存在s-pσ键,C. SO2中存在p-pπ键,D. SCl2中存在p-pσ键,据此答题;
(5)根据中心原子的价层电子对数确定其杂化方式;等电子体是具有相同的价电子数和相同原子数的微粒;
(6)根据均摊法确定晶胞中各种原子的个数,再确定其化学式,根据密度确定晶胞的体积,进而求得晶胞的边长,两个离得最近的钙是位于顶点和面心上的,它们的距离为晶胞边长的
| ||
| 2 |
解答:
解:(1)COCl2中C原子的价电子对数为
=3,C原子采取sp2杂化,中心原子无孤电子对,C与O原子之间形成C=O双键,其结构式是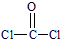 ,所以它的空间构型为平面三角形,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,其价电子排布式为4s24p5,
,所以它的空间构型为平面三角形,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,其价电子排布式为4s24p5,
故答案为:平面三角形;4s24p5;
(2)在离子晶体中离子半径越小,晶格能越大,比较两个反应的产物可知,由于氯离子的半径小于碘离子,所以CsCl的晶格能大于CsI的晶格能,故答案选A;
(3)第一电离能是指原子失去一个电子所需的能量,第一电离能越小,就越容易失去一个电子,比较表格中的数据可知,碘更容易形成较稳定的单核阳离子,故答案为:碘;
(4)A. HCl中存在s-pσ键,B.HF中存在s-pσ键,C. SO2中存在p-pπ键,D. SCl2中存在p-pσ键,
故答案为:D;
(5)因为氯原子周围有四对价层电子,所以中心原子的杂化方式为sp3杂化;CN-中有两个原子,价电子数为10个,根据等电子体是具有相同的价电子数和相同原子数的微粒可知,它的等电子体分子是N2或 CO,
故答案为:sp3杂化;N2或 CO;
(6)根据均摊法可知晶胞中钙离子的个数为8×
+6×
=4,过氧离子的个数为12×
+1=4,故其化学式为CaO2,设晶胞的边长为a,根据ρ=
,得a=
cm,两个离得最近的钙是位于顶点和面心上的,它们的距离为晶胞边长的
倍,即为
×
cm,
故答案为:CaO2;
×
;
| 4+2 |
| 2 |
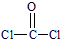 ,所以它的空间构型为平面三角形,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,其价电子排布式为4s24p5,
,所以它的空间构型为平面三角形,溴是35号元素,最外层电子为其价电子,4s能级上排列2个电子,4p能级上排列5个电子,其价电子排布式为4s24p5,故答案为:平面三角形;4s24p5;
(2)在离子晶体中离子半径越小,晶格能越大,比较两个反应的产物可知,由于氯离子的半径小于碘离子,所以CsCl的晶格能大于CsI的晶格能,故答案选A;
(3)第一电离能是指原子失去一个电子所需的能量,第一电离能越小,就越容易失去一个电子,比较表格中的数据可知,碘更容易形成较稳定的单核阳离子,故答案为:碘;
(4)A. HCl中存在s-pσ键,B.HF中存在s-pσ键,C. SO2中存在p-pπ键,D. SCl2中存在p-pσ键,
故答案为:D;
(5)因为氯原子周围有四对价层电子,所以中心原子的杂化方式为sp3杂化;CN-中有两个原子,价电子数为10个,根据等电子体是具有相同的价电子数和相同原子数的微粒可知,它的等电子体分子是N2或 CO,
故答案为:sp3杂化;N2或 CO;
(6)根据均摊法可知晶胞中钙离子的个数为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |
| ||
| a3 |
| 3 |
| ||
| ||
| 2 |
| ||
| 2 |
| 3 |
| ||
故答案为:CaO2;
| ||
| 2 |
| 3 |
| ||
点评:本题主要考查原子核外电子排布、晶格能、原子杂化轨道、晶胞的计算等知识点,中等难度,解题时注意基础知识的灵活运用.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案
相关题目
 现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.如图是已经合成的最著名的
现代无机化学对硫-氮化合物的研究是最为活跃的领域之一.如图是已经合成的最著名的硫-氮化合物的分子结构.下列说法正确的是( )
| A、该物质的分子式为SN |
| B、该物质的分子中既有极性键又有非极性键 |
| C、该物质可能是离子化合物 |
| D、该物质的一个分子中含有9个N-S键 |
下列物质中,无天然存在的是( )
| A、碳酸钠晶体 | B、过氧化钠 |
| C、芒硝 | D、氯化钠 |
下列有关硅的叙述中,不正确的是( )
| A、硅是一种亲氧元素,在自然界中大多以氧化物和硅酸盐的形式存在 |
| B、硅在地壳中的含量居第一位 |
| C、利用硅的半导体性能,可以制作光电池 |
| D、硅晶体的结构与金刚石类似 |
物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )
| A、NH4Cl |
| B、NH4HSO4 |
| C、CH3COONH4 |
| D、NH3?H2O |
化学与生活、社会密切相关.下列说法不正确的是( )
| A、凡含有食品添加剂的食物对人体健康均有害,不可食用 |
| B、提倡人们购物时不用塑料袋,是为了防止白色污染 |
| C、防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
| D、利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 |
下列说法正确的是( )
| A、Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性 |
| B、能使湿润的淀粉KI试纸变成蓝色的物质一定是Cl2 |
| C、SiO2与酸、碱均不反应 |
| D、分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水 |
