��Ŀ����
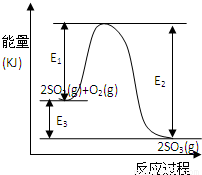
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮T��ʱ��Ӧ2SO2��g��+O2��g�� 2SO3��g�������е������仯��ͼ��ʾ���ش��������⣮
2SO3��g�������е������仯��ͼ��ʾ���ش��������⣮��1��д���÷�Ӧ���Ȼ�ѧ����ʽ����E1��E2��E3��ʾ����ͬ��______��
��2��T��ʱ��3molSO2��1molO2ͨ�����Ϊ2L�ĺ��º����ܱ������У�������Ӧ��2minʱ��Ӧ�ﵽƽ�⣬��ʱ��÷�Ӧ��O2��ʣ��0.1mol����ﵽƽ��ʱSO2��ת����Ϊ______����Ӧ______����ų��������ա���______����������E1��E2��E3��ʾ��
��3������������֤���÷�Ӧ�Ѵﻯѧƽ��״̬����______������ţ�
��SO2������������ٷ����仯 ��������ѹǿ���ٷ����仯 ������������ԭ���������ٷ����仯 ����ͬʱ��������2n molSO2��ͬʱ����n molO2 ����ͬʱ��������2n molSO2��ͬʱ����2n molSO3
��4���ڷ�Ӧ��ϵ�м����������Ӧ��������E1��E2��E3�ı仯�ǣ�E1______��E2______��E3______���������С�����䡱����
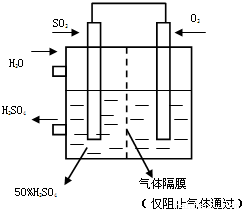
��5��������ͼ��ʾװ�ã��õ绯ѧԭ���������ᣬ��SO2��O2��һ��ѹǿ�絽���Ե缫�Ϸ�Ӧ��д�����缫�ĵ缫��Ӧʽ��______��Ϊ�ȶ�����������������Һ��Ũ��Ӧά�ֲ��䣬��ͨ��SO2��ˮ��������Ϊ______��
��6��SOCl2��һ����ɫҺ�壬����̼��ͬ����﮵�ص��������ϣ�����ŵ�ʱҲ��SO2���������д��SOCl2�ڵ���зŵ�ʱ�ĵ缫��Ӧʽ______��
��2������ת����=
 ×100%���㣻���ݷ�Ӧ�����������Ĺ�ϵʽ���㷴Ӧ�ȣ�
×100%���㣻���ݷ�Ӧ�����������Ĺ�ϵʽ���㷴Ӧ�ȣ���3�����ݻ�ѧƽ��״̬����������������Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ������ʵ�Ũ�ȡ���������������Լ��ٷֺ������䣬�Լ��ɴ�������һЩ��Ҳ�������仯������ʱҪע�ⷽ��ʽǰ������Ļ�ѧ�������Ĺ�ϵ��
��4�������ܸı䷴Ӧ��·����ʹ������Ӧ����Ļ�ܽ��ͣ�
��5�������������ϵ�ʧ����д����Ӧ�ĵ缫��Ӧʽ��
��6������ԭ��صĵ�ط�Ӧʽ����д������д��
����⣺��1����H=��Ӧ�����յ�����-������ų��������T-E3kJ/mol=-��E2-E1��kJ/mol��
�ʴ�Ϊ��2SO2��g��+O2��g��?2SO3��g����H=-E3kJ/mol ���H=-��E2-E1��kJ/mol
��2����ͼ��֪����Ӧ���������������������������Ը÷�Ӧ�Ƿ��ȷ�Ӧ��
2SO2��g��+O2��g��?2SO3��g�� ���� E3
��Ӧ��ʼ 3 mol 1mol 0 E3
ת�� 1.8 mol 0.9mol 1.8 mol 0.9E 3
ƽ�� 1.2mol 0.1mol 1.8 mol
����SO2��ת����=
 ×100%=60%
×100%=60%�ų����� 0.9E 3
�ʴ�Ϊ��60%���ų��� 0.9 E3��
��3���÷�Ӧǰ�����������С����ѧƽ��״̬�ı�־�����淴Ӧ������ȡ���ϵ�����ʵĺ������䣮
�٢ڢܷ�������������ԭ���غ㣬��Ԫ�ص�ԭ������ʼ�ղ��䣬�ʢ۴�������ָ����һ�£��ʢݴ���
��ѡ���٢ڢܣ�
��4������������ı��˷�Ӧ���̣��ı䷴Ӧ���ʣ���ƽ�ⲻ�ƶ�������E2��E1 ��С��E3���䣬
�ʴ�Ϊ��E2��E1 ��С��E3���䣻
��5������ԭ��ط�Ӧԭ������ԭ���ڸ����Ϸ���������Ӧ�缫��ӦʽΪSO2-2e-+2H2O�TSO42-+4H+�����������������Ϸ�����ԭ��Ӧ�缫��ӦʽΪO2+4e-+4H+�T2H2O����ԭ��صı�����2SO2+O2+2H2O=2H2SO4��Ϊά��Ũ�Ȳ��䣬SO2��O2��Ӧ�������������������50%�������ˮΪ��Ӧ��Ӧ��ˮ�����ܼ���ˮ������������Ϊ=2×64����2×18+2×98��=16��29
�ʴ�Ϊ��+��O2+4e-+4H+�T2H2O��-��SO2-2e-+2H2O�TSO42-+4H+�� 16��29��
��6��SOCl2��S�Ļ��ϼ���+4�ۣ����м��̬���ܷ���������ԭ��Ӧ����Ӧ���ж����������ɣ�Ҳ��S�������ɣ���ط�ӦʽΪ2SOCl2+4e-�TS+SO2��+4Cl-��
�ʴ�Ϊ��2SOCl2+4e-�TS+SO2��+4Cl-��
���������⿼��缫��Ӧʽ����д��ƽ��״̬���жϵ�֪ʶ�㣬�ѶȲ���ע�⻯ѧƽ��״̬���жϷ������Ǹ߿����ȵ㣬Ҳ��ѧϰ���ѵ㣮

 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д���1����֪1.0mol��L��1NaHSO3��Һ��pHΪ3.5�������Һ����Ũ�ȴӴ�С��˳��Ϊ �������ӷ��ű�ʾ����
 ��2����֤��Na2SO3��Һ�д���ˮ��ƽ��SO32��+H2O
��2����֤��Na2SO3��Һ�д���ˮ��ƽ��SO32��+H2O![]() HSO3��+OH������ʵ�� ������ţ���
HSO3��+OH������ʵ�� ������ţ���
A�������̪��Һ��죬�ټ���H2SO4��Һ��ɫ��ȥ
B�������̪��Һ��죬�ټ�����ˮ���ɫ��ȥ
C�������̪��Һ��죬�ڼ���BaCl2��Һ����������Һ�ɫ��ȥ
��3����ҵ�����ô�������Ӧ��SO2ת��ΪSO3��2SO2+ O2 ![]() 2SO3����ij�¶��£��˷�Ӧ����ʼŨ��c��SO2��=1.0mol��L��1��c��O2��=1.5mol��L��1���ﵽƽ���SO2��ת����Ϊ50%������¶��¸÷�Ӧ��ƽ�ⳣ��K�� ��
2SO3����ij�¶��£��˷�Ӧ����ʼŨ��c��SO2��=1.0mol��L��1��c��O2��=1.5mol��L��1���ﵽƽ���SO2��ת����Ϊ50%������¶��¸÷�Ӧ��ƽ�ⳣ��K�� ��
��4����������Һ�У������(KIO3)���������ƿɷ������·�Ӧ��
2IO3����5SO32����2H��===I2��5SO42����H2O
���ɵĵ�����õ�����Һ���飬���ݷ�Ӧ��Һ������ɫ�����ʱ���������÷�Ӧ�����ʡ�ijͬѧ���ʵ�����±���ʾ��
| 0.01mol��L��1 KIO3 ������Һ(������)�����/mL | 0.01mol��L��1 Na2SO3 ��Һ�����/mL | H2O����� /mL | ʵ�� �¶� /�� | ��Һ������ɫʱ����ʱ��/s | |
| ʵ��1 | 5 | V1 | 35 | 25 | |
| ʵ��2 | 5 | 5 | 40 | 25 | |
| ʵ��3 | 5 | 5 | V2 | 0 |
����V2=___________mL����ʵ���Ŀ����______________ ______��
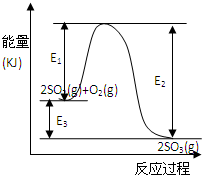 ���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮T��ʱ��Ӧ2SO2��g��+O2��g��?2SO3��g�������е������仯��ͼ��ʾ���ش��������⣮
���ô�������Ӧ��SO2ת��ΪSO3�ǹ�ҵ����������Ĺؼ����裮T��ʱ��Ӧ2SO2��g��+O2��g��?2SO3��g�������е������仯��ͼ��ʾ���ش��������⣮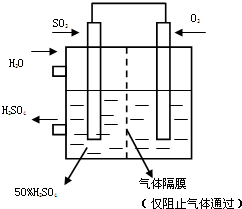

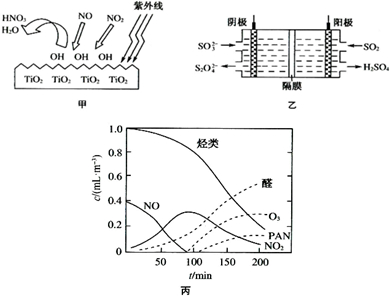
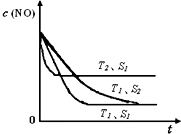 ���������Ǵ�����Ⱦ��֮һ��������������ķ����ж��֣�
���������Ǵ�����Ⱦ��֮һ��������������ķ����ж��֣�