题目内容
【题目】(1)工业上通过高温分解FeSO4的方法制备Fe2O3,化学方程式为:2FeSO4 ![]() Fe2O3+ SO3↑ + SO2↑为检验FeSO4高温分解的产物,进行如下实验:
Fe2O3+ SO3↑ + SO2↑为检验FeSO4高温分解的产物,进行如下实验:
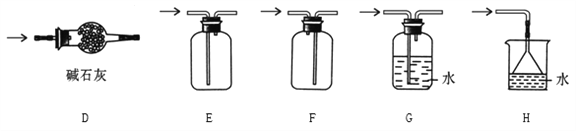
检验FeSO4高温分解产生的气体,将FeSO4高温分解产生的气体通入下图装置中。

① 装置A试管可选用的试剂是_________(填标号)。
a. 水 b. BaCl2溶液 c. Ba(NO3)2溶液 d. Ba(OH)2溶液
② 装置C的作用是防止尾气污染环境,试管中应加入的试剂是_________________。
③ 若装置B试管中溶液改为酸性KMnO4溶液,可以观察到溶液紫色褪去,反应的离子方程式为__________________________ 。
(2)工业上在一定温度和催化剂条件下用NH3将NO2还原生成N2,某同学在实验室中对NH3与NO2反应进行了探究。

①实验室可以用A、B或C装置制取氨气,如果用C装置,则该装置中烧瓶所盛放的试剂为________(写名称);反应的化学方程式是_____________________;
② 预收集一瓶干燥的氨气,选择下图中的装置,其气体收集和尾气处理装置连接顺序依次为:发生装置→_____________________(用字母表示)
③ 将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按下图装置进行实验。打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中,Y管观察到的实验现象是____________________ ,反应的化学方程式为 ______________________________。
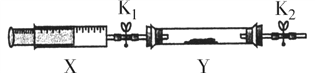
【答案】 b NaOH溶液 5SO2+2MnO4-+2H2O=5SO42- +2Mn2+ + 4H+ 氧化钙(或碱石灰、固体氢氧化钠等) NH3·H2O![]() NH3↑+H2O D F H 红棕色气体逐渐褪色 8NH3+6NO2
NH3↑+H2O D F H 红棕色气体逐渐褪色 8NH3+6NO2 ![]() 7N2 +12H2O
7N2 +12H2O
【解析】(1)①装置A中装氯化钡溶液,若产生白色沉淀,证明分解产物中有三氧化硫,故选b;装置B中品红溶液,若品红褪色,证明分解产物中含有二氧化硫;②为防止尾气污染环境,在装置C的试管中加入氢氧化钠溶液来吸收二氧化硫气体;③酸性KMnO4溶液将二氧化硫氧化为硫酸根离子,而本身被还原为锰离子,其离子方程式为:5SO2+2MnO4-+2H2O=5SO42- +2Mn2+ + 4H+;(2)①利用氨水易分解的性质,可以用C装置制取氨气,通常使用的药品是浓氨水和氧化钙或碱石灰、固体氢氧化钠等;反应的化学方程式为:NH3·H2O![]() NH3↑+H2O;②预收集一瓶干燥的氨气,则发生装置反应产生的氨气通过干燥选D,由于氨气极易溶于水,密度比空气小,只能选用F收集,尾气处理要防止倒吸,再选H,则其气体收集和尾气处理装置连接顺序依次为:发生装置→D F H;③NO2具有强氧化性,NH3有强还原性,两者相遇,会发生反应产生氮气和水,根据电子守恒、原子守恒,可得反应的方程式:8NH3+6NO2
NH3↑+H2O;②预收集一瓶干燥的氨气,则发生装置反应产生的氨气通过干燥选D,由于氨气极易溶于水,密度比空气小,只能选用F收集,尾气处理要防止倒吸,再选H,则其气体收集和尾气处理装置连接顺序依次为:发生装置→D F H;③NO2具有强氧化性,NH3有强还原性,两者相遇,会发生反应产生氮气和水,根据电子守恒、原子守恒,可得反应的方程式:8NH3+6NO2 ![]() 7N2 +12H2O,故Y管内看到红棕色气体颜色变浅最终变为无色,同时在注射器的内壁有水珠产生。
7N2 +12H2O,故Y管内看到红棕色气体颜色变浅最终变为无色,同时在注射器的内壁有水珠产生。



