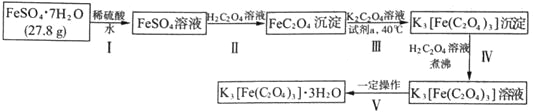
题目内容
【题目】下列有关图象对应的叙述中,错误的是( )
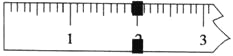
A. 图A表示常温下,将铜粉加入到一定量浓硝酸中,生成气体的体积与所加铜粉的质量之间的关系
图A表示常温下,将铜粉加入到一定量浓硝酸中,生成气体的体积与所加铜粉的质量之间的关系
B.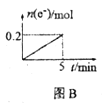 图B表示用惰性电极电解一定浓度的硫酸铜溶液,若通电5min后,加入0.1mol的氢氧化铜溶解,刚好恢复到通电前的浓度,则电解过程中转移的电子的物质的量
图B表示用惰性电极电解一定浓度的硫酸铜溶液,若通电5min后,加入0.1mol的氢氧化铜溶解,刚好恢复到通电前的浓度,则电解过程中转移的电子的物质的量
C. 图C表示在恒温恒容的密闭容器中,反应NH2COONH4(s)2NH3(g)+CO2(g)达平衡后,t1时缩小容器体积,t2时再达平衡时CO2的浓度变化
图C表示在恒温恒容的密闭容器中,反应NH2COONH4(s)2NH3(g)+CO2(g)达平衡后,t1时缩小容器体积,t2时再达平衡时CO2的浓度变化
D. 图D表示一定条件,在水溶液中1molCl-、ClOx-(x=1、2、3、4)的能量(kJ)相对大小由此可知,B→A+C反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H=-117kJmol-1
图D表示一定条件,在水溶液中1molCl-、ClOx-(x=1、2、3、4)的能量(kJ)相对大小由此可知,B→A+C反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq) △H=-117kJmol-1
【答案】B
【解析】
![]() 铜先和浓硝酸反应生成二氧化氮气体,随着反应的进行,浓硝酸变成稀硝酸,铜和稀硝酸反应生成一氧化氮,当硝酸完全反应时,生成的气体为定值,故A正确;
铜先和浓硝酸反应生成二氧化氮气体,随着反应的进行,浓硝酸变成稀硝酸,铜和稀硝酸反应生成一氧化氮,当硝酸完全反应时,生成的气体为定值,故A正确;
B.加入![]() 后恰好恢复到电解前的浓度,则电极产物分别为Cu、H2、O2,可知阴极有氢气生成,则包括了电解水的过程,电解包括了2个过程,2CuSO4+2H2O
后恰好恢复到电解前的浓度,则电极产物分别为Cu、H2、O2,可知阴极有氢气生成,则包括了电解水的过程,电解包括了2个过程,2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,2H2O
2Cu+O2↑+2H2SO4,2H2O![]() 2H2↑+O2↑,根据O守恒,一共生成了0.1molO2,O的化合价从-2升高到0,则生成0.1molO2,一共转移了2×0.2mol=0.4mol电子,故B错误;
2H2↑+O2↑,根据O守恒,一共生成了0.1molO2,O的化合价从-2升高到0,则生成0.1molO2,一共转移了2×0.2mol=0.4mol电子,故B错误;
C.t1缩小容器体积,CO2的浓度瞬时增大,但是压强增大,平衡向逆反应方向进行,CO2的浓度减小;温度不变,平衡常数不变,![]() ,NH3和CO2的浓度比例为固定比例2:1,K不变,则CO2的浓度不变;CO2的浓度先瞬间增大后减小,减小到与原平衡相同,故C正确;
,NH3和CO2的浓度比例为固定比例2:1,K不变,则CO2的浓度不变;CO2的浓度先瞬间增大后减小,减小到与原平衡相同,故C正确;
D.![]() 发生反应:
发生反应:![]() ,反应热=生成物的能量-反应物的能量,则反应热
,反应热=生成物的能量-反应物的能量,则反应热![]() ,故反应热化学方程式为:
,故反应热化学方程式为:![]() ,故D正确;
,故D正确;
故选:B。

 每课必练系列答案
每课必练系列答案